题目内容
【题目】用化学用语回答下列问题。
(1)氧化镁中镁元素的化合价_______;
(2)3个铝离子_______;
(3)化学反应 4HNO3![]() 2H2O+4NO2↑+X↑中X的化学式是_______。
2H2O+4NO2↑+X↑中X的化学式是_______。
【答案】+2 ![]() O2
O2
【解析】
(1)根据化合物中正负化合价代数和为零计算,氧化镁中氧元素的化合价通常显-2价,设镁元素的化合价为x,可列![]() ,解x=+2,故填:+2;
,解x=+2,故填:+2;
(2)离子的表示方法是元素符号右上角标注带电情况,数字在前,符号在后;多离子的表示方法在离子符号前加数字,3个铝离子表示方法:![]() ,故填:
,故填:![]() ;
;
(3)由反应的化学方程式4HNO3![]() 4NO2↑+2H2O+X↑,反应前氢、氮、氧原子个数分别为4、4、12,反应后已知的生成物中氢、氮、氧原子个数分别为4、4、10,则每个X分子由2个氧原子构成,物质X的化学式为O2,故填:O2。
4NO2↑+2H2O+X↑,反应前氢、氮、氧原子个数分别为4、4、12,反应后已知的生成物中氢、氮、氧原子个数分别为4、4、10,则每个X分子由2个氧原子构成,物质X的化学式为O2,故填:O2。

 名校课堂系列答案
名校课堂系列答案【题目】人类社会发展离不开金属材料,结合所学知识,回答下列问题:
(1)生活中使用的金属材料大多是合金,而不是纯金属,这是因为合金具有更多优良性能。下列属于合金的是_________(填序号)。
a 黄铜 b 铝 c 生铁
(2)铁是化学性质比较活泼的金属,它在自然界主要以_____(填“单质”或“化合物”)的形式存在,为了防止铁栏杆生锈可采取的措施是__________。铝比铁具有更好的抗腐蚀性的原因___________。
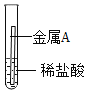
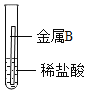
(3)某学习小组在学习金属的化学性质时,进行如下实验:
实验操作 |
|
|
实验现象 | 金属表面产生气泡 | 金属表面无明显现象 |
由实验可知,两种金属的活动性顺序是A__________B(填“>”或“<”),若金属A为铁,则反应的化学方程式为_______。
(4)将一定量的铝粉投入硝酸铜、硝酸锌、硝酸银的混合溶液中充分反应后过滤,得到滤液和滤渣。下列说法正确的是__________(填序号)。
A 若滤渣中有3种金属,则滤液中可能有3种金属离子
B 若滤液为蓝色,则滤渣的组成有2种情况
C 取少量滤渣,加入足量的稀盐酸,产生气泡,则滤液中一定没有锌离子
D 取少量滤液,加入适量的氯化钠溶液,产生白色沉淀,则滤渣中一定没有银
【题目】某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘了滴加酸碱指示剂,因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
[提出问题]该烧杯中溶液的溶质是什么?
[猜想与假设]同学们提出如下四种猜想:
猜想一:只有CaC l2;
猜想二:含有CaCl2和__;
猜想三:含有CaCl2和HCl;
猜想四:含有CaCl2、HCl和Ca(OH)2。
同学们经过讨论后一致认 为猜想_____不正确,理由是______。
[查阅资料]氯化钙溶液呈中性。
[进行实验]同学们设计了如下实验方案进行探究,请你帮他们填写有关实验步骤及实验现象。
实验方案 | 实验步骤 | 实验现象 |
方案一 | 取少量烧杯中的溶液于试管中,滴加几滴紫色石蕊溶液 | ______ |
方案二 | 取___于试管中,加入一定量的烧杯中的溶液 | 产生气泡 |
方案三 | 取少量烧杯中的溶液于另一只试管中,滴加适量的AgNO3溶液 | 产生白色沉淀 |
[得出结论]猜想三成立。方案二中发生反应的化学方程式为______。
[交流反思](1)老师看过他们的实验报告后指出,方案三不能证明猜想三成立。原因是____。
(2)为了保护环境,需将废液处理之后再排收,可以向烧杯中加入适量的________。