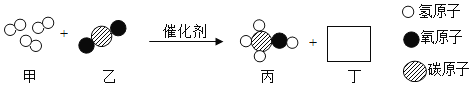
题目内容
【题目】同学们利用假日去参观博物馆,发现一些青铜器(铜、锡合金)表面呈绿色。老师告诉他们,这是铜器长期暴路在空气中生成了铜锈的结果。为了弄清这种绿色铜锈的元素组成,回来后,他们在实验室进行了如下探究:

[查阅资料](1)铜锈俗称铜绿,受热易分解。
(2)无水硫酸铜是一种白色粉末,化学式为CuSO4,遇水变蓝,通常实验用作证明有无水分存在。
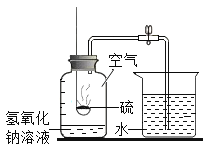
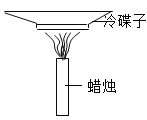
[实验设计1]采用如图装置进行实验。
[实验步骤]
(1)检查装置的气密性;
(2)装药品:
(3)固定、连接仪器;盛有铜绿的试管应_____固定在铁架台上;
(4)点燃酒精灯;
(5)停止加热。
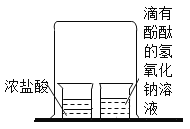
[实验现象](1)B中观察到的现象为_____,证明铜绿受热生成了水。
(2)C中观察到澄清石灰水变浑浊,化学方程式为_____。
加热一会儿后,A试管中观察到固体由绿色变为黑色。生成的黑色物质是什么呢?他们进一步进行探究:
[实验设计2]
实验步骤 | 实验现象 | 实验结论 |
取少量A中的黑色固体于试管中,加入足量的_____ | 黑色固体消失,_____ | 黑色固体是氧化铜 |
[实验结论]铜绿中含有_____元素。
[交流与反思]B与C装置能否互换位置,请说明原因:_____。
【答案】试管口略向下倾斜 粉末由白色变为蓝色 ![]() 稀盐酸(或稀硫酸) 溶液由无色变为蓝色 铜、氧、氢、碳 不能,B与C互换位置就不能证明有水生成,进而不能证明铜绿中含有氢元素
稀盐酸(或稀硫酸) 溶液由无色变为蓝色 铜、氧、氢、碳 不能,B与C互换位置就不能证明有水生成,进而不能证明铜绿中含有氢元素
【解析】
[实验步骤](3)铜绿是一种固体物质,给固体加热时,为防止水分倒流引起试管受热不匀发生炸裂,试管口应略向下倾斜,故填试管口略向下倾斜。
[实验现象](1)无水硫酸铜是一种白色粉末,遇水会变蓝,如果铜绿受热生成了水,观察到的现象是粉末由白色变为蓝色,故填粉末由白色变为蓝色;
(2)C中观察到澄清石灰水变浑浊,其中的反应是澄清石灰水中的氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,故反应的化学方程式写为:Ca(OH)2+CO2=CaCO3↓+H2O。
[实验设计2]由实验结论可知,该黑色固体为氧化铜,氧化铜能与酸反应生成铜盐和水,所以可以取适量的黑色固体,然后向固体中加入足量的稀盐酸或稀硫酸,故填稀盐酸(或稀硫酸);
氧化铜与稀盐酸或稀硫酸反应后生成氯化铜或硫酸铜,氯化铜与硫酸铜溶于水后溶液均呈蓝色,故填溶液由无色变为蓝色。
[实验结论]铜绿反应后的气体使无水硫酸铜变蓝,说明反应生成水,水由氢元素与氧元素组成,表明铜绿中含有氢元素与氧元素,反应后生成了使澄清石灰水变浑浊的二氧化碳,说明铜绿中含有碳元素,生成的黑色固体为氧化铜,还说明铜绿中含有铜元素,即铜绿中含有铜、氧、氢、碳四种元素,故填铜、氧、氢、碳。
[交流与反思] 如果B与C装置互换位置,观察到C中的澄清石灰水变浑浊,然后从 C导出的气体中会含有水分,这些水分也能使B中的无水硫酸铜变蓝,而无法确定铜绿反应是否生成了水,进而无法判断铜绿中是否含有氢元素,所装置B与C的位置不能互换,故填不能,B与C互换位置就不能证明有水生成,进而不能证明铜绿中含有氢元素。

 阅读快车系列答案
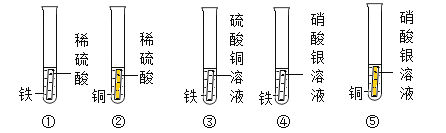
阅读快车系列答案【题目】图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
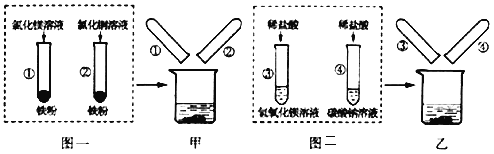
(1)在图一所示的实验中,试管②中发生反应的化学方程式是_____。
(2)甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是_____(填序号)
A.试管②反应后的固体中一定不含铁
B.完全反应后,甲烧杯中的固体一定含有铁
C.完全反应后,甲烧杯的溶液中可能含有Cu2+
D.完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+
(3)乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管④反应后的溶液中的溶质共有哪些_____(写化学式)。
(4)将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
实验操作 | 实验现象 | 实验结论 |
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液, | 有白色沉淀生成 | ①生成的白色沉淀是_____(写化学式,下同) ②滤液中的溶质共有哪些_____ |
步骤2:静置,向上层清夜中滴加无色酚酞试液 | 溶液变红 |
(5)在上述(4)的实验探究中,步骤1中加入足量硝酸钡溶液的目的是_____。