题目内容
【题目】回答下列问题:
(1)有的胃病患者胃酸过多,常服用一些含氢氧化铝的药物,有关反应的化学方程式为_____。
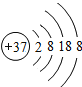
(2)铷(Rb)是一种银白色蜡状金属,质软而轻,其化学性质比钾活泼。下图表示铷元素的_____(填“原子”、“阳离子”或“阴离子”)结构示意图。由图可知,铷元素应位于元素周期表中的第_____周期,硫酸铷的化学式为_____。
(3)为维护食品安全,卫生部禁止在面粉中添加增白剂,如过氧化钙(CaO2)等。它和水反应能生成一种碱和一种无色能供给人呼吸的气体,该反应的化学方程式是_____。
【答案】Al(OH)3+3HCl===AlCl3+3H2O 阳离子 5 Rb2SO4 2CaO2+2H2O====2Ca(OH)2+O2↑
【解析】
(1)胃酸的主要成分是盐酸,盐酸与氢氧化铝反应生成氯化铝和水,反应的化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O;
(2)根据微粒结构示意图可知,核电荷数=质子数>核外电子数,为阳离子;失去最外层电子还余四个电子层,因此该元素位于元素周期表的第五周期;铷元素的化合价为+1,硫酸根的化合价为-2,硫酸铷的化学式为:Rb2SO4;
(3)根据质量守恒定律可知,过氧化钙和水反应能生成一种碱(氢氧化钙)和一种无色能供给人呼吸的气体(氧气),该反应的化学方程式是:2CaO2+2H2O=2Ca(OH)2+O2↑。

练习册系列答案
相关题目