题目内容
【题目】工业上采用电解法制备氯酸钾。电解池中的电解质是氯化钾,电解产生的Cl2与KOH混合,就得到KC1O3溶液,浓缩冷却结晶即可得到氰酸钾晶体。反应原理:
①2KCl+2H2O![]() Cl2↑+2KOH+H2↑
Cl2↑+2KOH+H2↑
②3Cl2+6KOH=KClO3+5KCH+3H2O,
下列说法正确的是( )
A. KClO3中氯元素的化合价是+7
B. 反应①属于复分解反应
C. KClO3属于盐类物质
D. KOH和Cl2是主要的反应原料
【答案】C
【解析】
A、化合物中正负化合价代数和为零,钾元素显+1,氧元素显﹣2,设氯元素的化合价是x,可知KClO3中氯元素的化合价:(+1)+x+(﹣2)×3=0,则x=+5,故错误;
B、复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,反应①的生成物中有单质,不是复分解反应,故错误;
C、由金属元素和酸根组成的化合物属于盐,KClO3属于盐,故正确;
D、Cl2是第一个反应的生成物,Cl2不是主要的反应原料,故错误。
故选:C。

练习册系列答案
相关题目
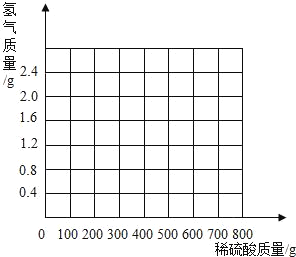
【题目】某化学兴趣小组为了分析生铁中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸质量(g) | 200 | 200 | 200 | 200 |
剩余固体质量(g) | 37.6 | 15.2 | 4 | 4 |
(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为_____.
A 铁 B 铁和碳 C 碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)_____
(3)计算所用稀硫酸的溶质质量分数为多少?_____(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图._____