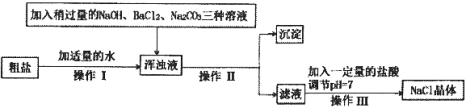
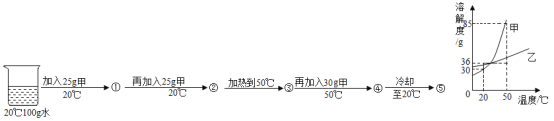
��Ŀ����
����Ŀ��ij��ѧ��ȤС����λͬѧ��ѧϰ�������������Ʒ�Ӧ�ֱ����Լ���ʵ������������ʵ�飬���Ӳ�ͬ����������ͼ��������ͼA��ʵ�ʲ���ͼ��ͼB�Ƿ�Ӧ��������Һ�����ȱ仯ͼ��ͼC�������ӽ�Ϲ��̵�ʾ��ͼ��
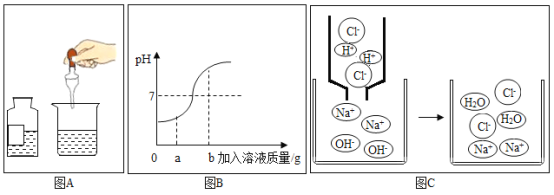
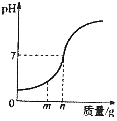
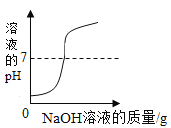
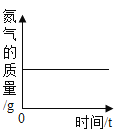
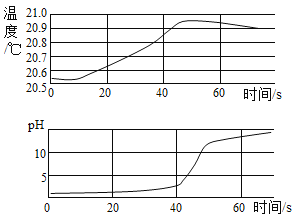
����ͼB�����߱仯���ش��������⣺
��1���ñ仯��Ӧ��ʵ������ǽ�________�μӵ���һ����Һ�У�
��2����������Һ������Ϊagʱ����Һ�е�����Ϊ________���ѧʽ����
��3������Һ��pH=7ʱ����Һ�е���Ҫ������________�������ӷ��ţ���
��4����������Һ������Ϊbgʱ����������Һ�еμ���ɫʯ����Һ����Һ��________ɫ��
�����ۣ��ӷ�Ӧǰ�����ӵ��������Щ���Ӳ����˷�Ӧ����Щ����ֻ���Թ��ߣ��÷�Ӧ�в��뷴Ӧ��������________��
���𰸡���1������������Һ����2��HCl��NaCl�� ��3��Na+��Cl������4�����������ۡ������ӣ����������ӡ�
��������
��1�������pH�仯����С��7������7�Ĺ��ɣ���˽��еIJ����ǽ�����������Һ�μӵ�ϡ�����У�
��2����������Һ������Ϊagʱ����Һ�������ԣ�������Һ�е�����Ϊ�Ȼ�����Ȼ��ƣ���ѧʽ�Ƿֱ���HCl��NaCl��
��3������Һ��pH=7ʱ�����ǡ����ȫ��Ӧ����Һ�е���Ҫ�����������Ӻ������ӣ����ӷ�����Na+��Cl����
��4����������Һ������Ϊbgʱ��������Һ�Լ��ԣ���ʹʯ����Һ����ɫ��
[����]�кͷ�Ӧ��ʵ���������������Ӻͼ������������������������ˮ�Ĺ��̣����кͷ�Ӧ��ʵ����H++OH��=H2O��

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ��ǣ� ��
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ��ȥCO�е����� | ��ͨ��Ũ������ͨ������������Һ |
B | ��ȥ�����е�ͭ�� | ����������ϡ |
C | ��ȥ | ���������� |
D | ���� | �������� |
A.AB.BC.CD.D