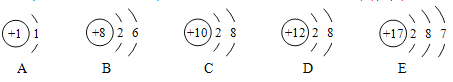题目内容
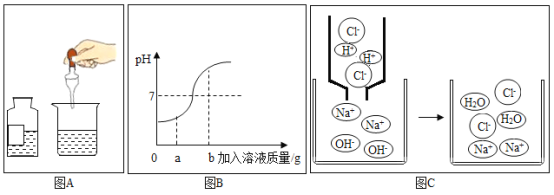
【题目】实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。
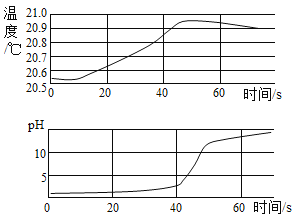
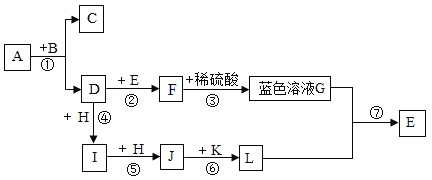
(1)发生的反应可用化学方程式表示为________;
(2)40 s时,溶液中溶质有________种;
(3)下列说法错误的是________。
A 反应过程中有热量放出
B 该实验是将稀盐酸滴入稀NaOH溶液
C 从20 s到40 s,溶液的温度升高、pH增大
【答案】NaOH+HCl═NaCl+H2O 两 B
【解析】
(1)氢氧化钠与稀盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl═NaCl+H2O。
(2)40s时放出的热量还没有达到最高,还没有完全反应,稀盐酸有剩余,40s时溶液中的溶质为氯化氢和氯化钠。
(3)A.由稀NaOH溶液与稀盐酸反应过程中温度变化图,反应过程中温度逐渐升高,有热量放出,故选项说法正确。
B.图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,该实验是将稀氢氧化钠溶液滴入稀盐酸中,故选项说法错误。
C.从20s到40s,溶液的温度升高,酸性逐渐减弱,pH增大,故选项说法正确。
故答案为:
(1)NaOH+HCl═NaCl+H2O;
(2)两;
(3)B。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目