题目内容
【题目】酸、碱、盐在我们的生活中有着重要作用。
(1)下列关于酸、碱、盐的说法不正确的是_____
①酸、碱、盐中一定含有非金属元素;
②酸、碱、盐的水溶液均可导电;
③大多数的酸和碱都有腐蚀性;
④所有的酸、碱、盐之间都能发生复分解反应
(2)只用一种试剂一次就可鉴别出稀硫酸、澄清石灰水、氯化钠溶液,这种试剂是____。
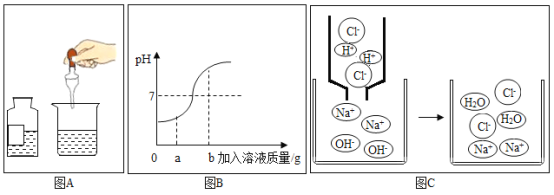
(3)用氢氧化钠中一定量的盐酸时,溶液的pH与加入的氢氧化钠质量的关系入如图所示。当加入氢氧化钠mg时,溶液中的溶质为___。若改用ng氢氧化钙与相同量盐酸反应,所得溶液的pH___(填“>”“<”或“=”)7。
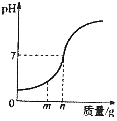
(4)食盐是一种重要的化工原料。粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质。将粗盐进行精致的流程如图:
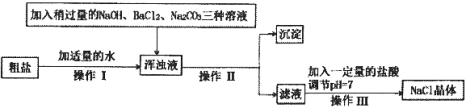
①加入NaOH、BaCl2、Na2CO3的顺序还可以改变吗?若能改变则写出改变的顺序,若不能改变,请说明理由____。
②通过操作Ⅱ所得滤液中的溶质有那些?____。
③在操作Ⅲ中玻璃棒的作用是什么?____。
(5)现有25g久置于空气中的氢氧化钠样品,为测定该样品变质的情况,将其配制成400mL溶液,取出200mL,滴入足量BaCl2,测得产生BaCO3的质量为19.7g。请通过计算判断样品是完全变质还是部分变质?____。
【答案】④ 碳酸钠溶液 生成的NaCl和剩余HCl < 不可以改变,理由是氢氧化钠是将镁离子沉淀,氯化钡是将硫酸根离子除去,碳酸钠是将钙离子除去,过量的氯化钡需要用碳酸钠除去,改变氯化钡和碳酸钠的顺序,氯化钠中可能有氯化钡。 Na2CO3、NaCl、NaOH 使滤液受热均匀,以免液滴飞溅; 部分变质
【解析】
(1)①酸一定含有氢元素,碱一定含有氢氧元素,盐中一定酸根,所以也一定含有非金属元素,故正确;
②酸、碱、盐如果可溶,则对应的水溶液均可导电,故正确;
③大多数的酸和碱都有腐蚀性,故正确;
④所有酸、碱盐之间不一定都能反应,所以更不可能都能发生复分解反应,故不正确。故选④。
(2)用一种试剂一次就可鉴别出稀硫酸、澄清石灰水、氯化钠溶液,这种试剂是碳酸钠溶液(其他可溶性碳酸盐溶液也可以)。加入碳酸钠溶液,生成气体的原溶液为稀硫酸,生成沉淀的原溶液为澄清石灰水,无明显现象的为氯化钠溶液。
(3)用氢氧化钠中和一定量的盐酸时,溶液的pH与加入的氢氧化钠 质量的关系如图1所示。当加入氢氧化钠mg时,此时pH<7显酸性,所以溶液中的溶质为生成的NaCl和剩余HCl。
![]() ,
,![]()
若改用ng氢氧化钙与相同量盐酸反应,假设n=74g,则对应的HCl为73g,消耗的氢氧化钙的质量为74g,则剩余盐酸,所以所得溶液的pH<7。
(4) ①加入NaOH、BaCl2、Na2CO3的顺序不可以改变,理由是氢氧化钠是将镁离子沉淀,氯化钡是将硫酸根离子除去,碳酸钠是将钙离子除去,过量的氯化钡需要用碳酸钠除去,改变氯化钡和碳酸钠的顺序,氯化钠中可能有氯化钡。
②通过操作Ⅱ所得滤液中的溶质有Na2CO3、NaCl、NaOH。
③操作Ⅲ为蒸发,故玻璃棒的作用是使受热均匀,防止发生迸溅。
(5)设200mL溶液中碳酸钠的质量为x
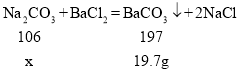
![]()
![]()
则400mL溶液中碳酸钠的质量为![]()
21.2g<25g
故样品部分变质。

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】氨水是工业制取氮肥的重要原料,在一定条件下,可将氨气![]() 溶于水制得。
溶于水制得。
(1)工业上利用氮气和氢气反应制氨气,反应的化学方程式为______________。(不要求注明条件)
(2)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
____________ | ___________ |
(3)小明将滴有酚酞的稀氨水加热,观察到溶液红色变浅,原因可能是_________。