题目内容
【题目】化学兴趣小组的同学欲测定实验室中某合金黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
查阅资料:(1)合金是由一种金属元素跟其他金属或非金属元素熔合而成的、具有金属特性的物质。合金的种类很多,用途非常广泛,黄铜是铜(Cu)和锌(Zn)的合金,它可以用来制造机器和电器的零件等。
(2)铜与稀盐酸不反应,锌与稀盐酸发生的化学反应为:![]() 。
。
实验探究:称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | 0.04 | 0.02 |
试求;此黄铜样品中铜的质量分数是多少?____(写出计算过程,质量分数用百分数表示。)
【答案】67.5%(详见解析)
【解析】
根据第一次加入15mL稀盐酸生成氢气0.04g,第二次生成0.04g,第三次生成0.02g,可以确定锌已完全反应,生成的氢气的质量=0.04g+0.04g+0.02g=0.1g;
设:生成0.1g氢气需要锌的质量为x。
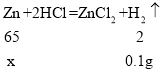
![]() x=3.25g;
x=3.25g;
黄铜样品中铜的质量=10g-3.25g=6.75g;
黄铜样品中铜的质量分数=![]() 。
。
答:此黄铜样品中铜的质量分数是67.5%。

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目