题目内容
【题目】根据下列有关实验回答问题:

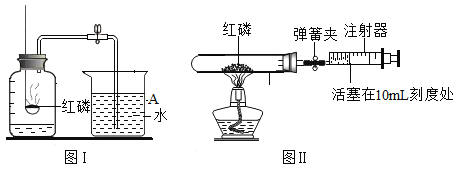
(1)A中向玻璃片“哈气”,是为了证明,与空气相比人体呼出的气体中含有较多的___________。
(2)B组实验是探究蜡烛燃烧的实验,蜡烛燃烧时火焰分_____层;取一内壁沾有澄清石灰水的烧杯罩在火焰上方,观察到烧杯内_____________,说明蜡烛燃烧的生成物中有___________。
(3)通过C、D实验的对比,可以得出的实验结论是燃烧的剧烈程度与___________________有关。如果D实验中取出的硫在空气中继续燃烧,此时应当采取的措施是____________(填序号)。这样做的目的是____________。
A让它继续在空气中烧完 B放入水中
(4)E组实验_______(填“能”或“不能”)比较二氧化锰和氧化铜的催化效果
【答案】水蒸气 三 澄清石灰水变浑浊 二氧化碳 氧气的浓度 B 防止硫燃烧的生成物污染空气 不能
【解析】
(1)向玻璃片“哈气”,玻璃片上出现水雾,说明与空气相比人体呼出的气体中含有较多的水蒸气;
(2)蜡烛燃烧时火焰分三层;取一内壁沾有澄清石灰水的烧杯罩在火焰上方,观察到烧杯内澄清石灰水变浑浊,说明蜡烛燃烧的生成物中有二氧化碳;
(3)通过C、D实验的对比可知,硫在氧气中燃烧比在空气中燃烧剧烈,可以得出的实验结论是燃烧的剧烈程度与氧气的浓度有关;硫在点燃的条件下和氧气反应生成二氧化硫,二氧化硫是一种有刺激性气味的有毒气体,所以如果实验中从集气瓶中取出的硫仍在燃烧应把它立即放入水中,使硫熄灭,以防止硫燃烧的生成物污染空气;
(4)要比较二氧化锰和氧化铜的催化效果,所用的过氧化氢溶液的浓度应该相同,故E组实验 不能比较二氧化锰和氧化铜的催化效果。

【题目】化学兴趣小组的同学欲测定实验室中某合金黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
查阅资料:(1)合金是由一种金属元素跟其他金属或非金属元素熔合而成的、具有金属特性的物质。合金的种类很多,用途非常广泛,黄铜是铜(Cu)和锌(Zn)的合金,它可以用来制造机器和电器的零件等。
(2)铜与稀盐酸不反应,锌与稀盐酸发生的化学反应为:![]() 。
。
实验探究:称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | 0.04 | 0.02 |
试求;此黄铜样品中铜的质量分数是多少?____(写出计算过程,质量分数用百分数表示。)