题目内容
某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如图实验方案.结合实验方案回答下列问题: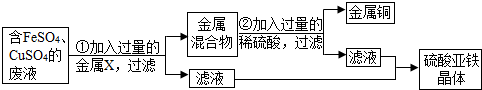
(1)步骤①中,金属X是 ,该反应的化学方程式为
(2)步骤②中,加入过量稀硫酸的目的是
(3)从滤液中获得硫酸亚铁晶体采用的方法是 .进行该操作所需的玻璃仪器有 .

(1)步骤①中,金属X是
(2)步骤②中,加入过量稀硫酸的目的是
(3)从滤液中获得硫酸亚铁晶体采用的方法是
考点:金属的化学性质,过滤的原理、方法及其应用,结晶的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.
解答:解:(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发,蒸发需要的仪器是:蒸发皿、玻璃棒、酒精灯、铁架台.
故答案为:(1)铁(或Fe); Fe+CuSO4=Cu+FeSO4;
(2)除去铜中的铁;(3)蒸发; 蒸发皿、玻璃棒、酒精灯、铁架台.
(2)步骤②中,加入过量稀硫酸的目的是除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发,蒸发需要的仪器是:蒸发皿、玻璃棒、酒精灯、铁架台.
故答案为:(1)铁(或Fe); Fe+CuSO4=Cu+FeSO4;
(2)除去铜中的铁;(3)蒸发; 蒸发皿、玻璃棒、酒精灯、铁架台.
点评:本题利用金属活动性的顺序考查了物质回收的探究,难度不大,依据金属活动性顺序中金属和酸、盐溶液间的反应关系分析即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
取4.9g氯酸钾和1.0g二氧化锰加热一段时间后,冷却至室温,测得剩余物质质量为3.98g,则剩余物质的成分是( )
| A、氯酸钾 |
| B、氯化钾和二氧化锰 |
| C、氯酸钾和二氧化锰 |
| D、氯酸钾、氯化钾和二氧化锰 |
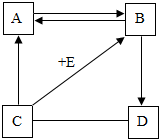 如图所示A、B、C、D、E是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应,“+”表示与某物质发生反应,部分反应物和生成物未标出.已知A是气体单质,B是最常用的溶剂,D常用于改良酸性土壤,E俗称小苏打.
如图所示A、B、C、D、E是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应,“+”表示与某物质发生反应,部分反应物和生成物未标出.已知A是气体单质,B是最常用的溶剂,D常用于改良酸性土壤,E俗称小苏打. 人类的生产生活离不开金属,铁是目前使用最广泛的金属.
人类的生产生活离不开金属,铁是目前使用最广泛的金属.