题目内容
1673年,英国化学家波义耳在一只敞口的容器中加热金属汞,结果发现反应后容器中物质质量增加(变成了氧化汞),因此,波义耳错过了发现质量守恒定律的机会.
(1)写出实验中所发生反应的化学方程式,并解释原因.你如何改进该实验?
(2)小明同学称取2g镁条,在酒精灯上点燃后,将落在石棉网上的白色固体称量,发现也是2g,于是他宣称,通过此实验可验证在化学反应中物质质量守恒.小明的说法对吗?为什么?
(1)写出实验中所发生反应的化学方程式,并解释原因.你如何改进该实验?
(2)小明同学称取2g镁条,在酒精灯上点燃后,将落在石棉网上的白色固体称量,发现也是2g,于是他宣称,通过此实验可验证在化学反应中物质质量守恒.小明的说法对吗?为什么?
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
解答:解:(1)汞和氧气反应的化学方程式为:2Hg+O2
2HgO;
因为反应后的物质质量等于参加反应的氧气和金属汞的质量之和,所以反应后质量增加;
改进方法是:在一密闭容器内进行实验,并称量反应前后整个容器的质量.
(2)不对,根据质量守恒定律,反应后生成的氧化镁质量应等于参加反应的氧气和镁的质量之和,有一部分氧化镁以白烟的形式扩散到空气中,故石棉网上的白色固体质量比生成的氧化镁要少.
| ||
因为反应后的物质质量等于参加反应的氧气和金属汞的质量之和,所以反应后质量增加;
改进方法是:在一密闭容器内进行实验,并称量反应前后整个容器的质量.
(2)不对,根据质量守恒定律,反应后生成的氧化镁质量应等于参加反应的氧气和镁的质量之和,有一部分氧化镁以白烟的形式扩散到空气中,故石棉网上的白色固体质量比生成的氧化镁要少.
点评:运用体系分析法和质量守恒思想解题,化学反应前后,参加反应的反应物的质量总和等于反应后生成的各物质的质量总和,用有气体生成或气体参加的反应验证质量守恒定律时,应在密封装置中实验、称量、验证.

练习册系列答案
相关题目
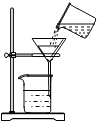 我市某化学兴趣小组的同学用洁净的塑料瓶从釜溪河中取回一定量的水样,然后进行如下研究分析:
我市某化学兴趣小组的同学用洁净的塑料瓶从釜溪河中取回一定量的水样,然后进行如下研究分析: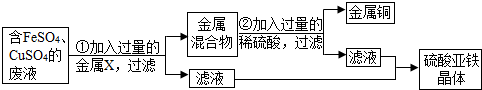

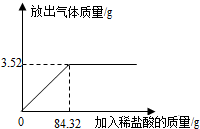 为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图,见图.
为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图,见图.
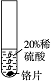
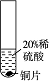
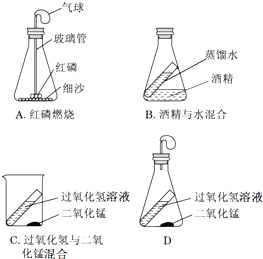 某科学兴趣小组的同学设计了如下三个实验装置(天平略)来验证质量守恒定律.
某科学兴趣小组的同学设计了如下三个实验装置(天平略)来验证质量守恒定律.