��Ŀ����
����Ŀ���������ƣ��׳����ռ�����һ�ְ�ɫ���壬�ǻ�ѧʵ�����бر��Ļ�ѧƷ�� ��Ϊ�����Ļ���Ʒ֮һ���������Ƶ���;���㣬������ֽ��ӡȾ���Ʊ���������ѧ��ά�� ұ��������ʯ�;��Ƶȷ��档��ҵ���ô����ʯ��ʯΪԭ���Ʊ��ռ��Ҫ������ͼ��ʾ��
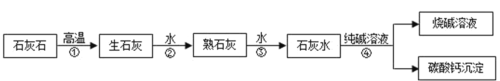
��1��д�����̢��з�����Ӧ�Ļ�ѧ����ʽ_________�� ���̢ڷ�Ӧ��_________�������ų���������������������
��2���ڹ��̢٩����У�û���У��漰���ķ�Ӧ������_____��Ӧ���������������ֽ������û��������ֽ���֮һ����
��3���������ƹ�����Ҫ�ܷⱣ�棬������Ϊ��¶�ڿ����еĹ������������������տ��� �е�ˮ���������ܽ⣬������������е�_____��д��ѧʽ����Ӧ�����ʡ�
��4��СѩͬѧΪ̽���������ƹ����Ƿ��ѱ��ʣ�������·�����ȡ������������ˮ�У� �μӼ�����ɫ��̪��Һ������̪��Һ���ɫ����֤���������ƹ���û�б��ʡ�����Ϊ����ʵ�鷽���Ƿ������˵�����ɣ�______________��
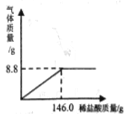
��5�����������ƹ����Ѿ����ֱ��ʣ����Բ��ü�������������Һ�ķ�����ȥ���е����� ̼���ơ��ֽ� 10g ����������Ʒ���ڸɾ����ձ��У����� 100g ˮʹ������ȫ�ܽ⣬�����Һ�в��ϼ�������������Һ�������������������������������Һ��������ϵ��ͼ��ʾ���Իش��������⣺
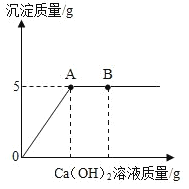
�ٵ���������������Һ��������ͼ�� B ��ʱ����Һ�к��е�����Ϊ_____��д��ѧʽ����
������Һ�м���һ��������������Һʱ����������ǡ���� ȫ��Ӧ����ͨ�����㣬���ʱ��Ӧ��������Һ�����ʵ��� ������������ȷ�� 0.1g��_______________��
���𰸡�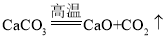 �ų� �û� CO2 ������������������Һ�������ɵ�̼�����Լ��ԣ�ͬ����ʹ��ɫ��̪��� NaOH��Ca(OH)2 8.7g
�ų� �û� CO2 ������������������Һ�������ɵ�̼�����Լ��ԣ�ͬ����ʹ��ɫ��̪��� NaOH��Ca(OH)2 8.7g
��������
��1����Ӧ��Ϊ̼����ڸ��µ������·�Ӧ���������ƺͶ�����̼���÷�Ӧ�Ļ�ѧ����ʽΪ��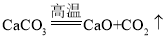 ��
��
��Ӧ��Ϊ��������ˮ��Ӧ�����������ƣ��÷�Ӧ�ų�������
��2����Ӧ��Ϊ̼����ڸ��µ������·�Ӧ���������ƺͶ�����̼���÷�Ӧ���ϡ�һ��ࡱ����ɫ�����ڷֽⷴӦ��
��Ӧ��Ϊ��������ˮ��Ӧ�����������ƣ��÷�Ӧ���ϡ����һ�����ص㣬���ڻ��Ϸ�Ӧ��
��Ϊ������������ˮ�γ�ʯ��ˮ�����������仯��
��Ӧ��Ϊ����������̼���Ʒ�Ӧ����̼��ƺ��������ƣ��÷�Ӧ���ϡ����ֻ����ﻥ�ཻ���ɷ������������ֻ�����ķ�Ӧ�����ڸ��ֽⷴӦ��
��û���漰���ķ�Ӧ�����ǣ��û���Ӧ��
��3��������������������еĶ�����̼��Ӧ����̼���ƺ�ˮ���Ӷ����ʣ����CO2��
��4��������������������еĶ�����̼��Ӧ����̼���ƺ�ˮ�������ʣ�̼���ƺ��������ƶ��Լ��ԣ�����ʹ��ɫ��̪��Һ��죬������ʵ�鷽�������������������������������Һ�������ɵ�̼�����Լ��ԣ�ͬ����ʹ��ɫ��̪��죻
��5��������������̼���Ʒ�Ӧ����̼��ƺ��������ƣ���ͼ��֪������������������Һ��������ͼ�� B ��ʱ���������ƹ���������Һ�к��е�����Ϊ��NaOH��Ca(OH)2��
�ڽ⣺����Ʒ��̼���Ƶ�����Ϊ x������ NaOH ������Ϊ y
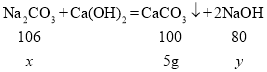
![]() x=5.3g
x=5.3g
![]() y=4g
y=4g
�ʷ�Ӧ��������Һ�����ʵ�����Ϊ��10g-5.3g+4g��8.7g
�𣺷�Ӧ��������Һ�����ʵ�����Ϊ 8.7g��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�