题目内容
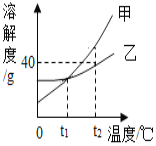
【题目】利用如图所示的实验探究物质的性质,下列叙述不正确的是

A.若①有蓝色沉淀生成,则R可能为氢氧化钡溶液
B.若②溶液变红,则R可能为酚酞溶液
C.若③有气泡产生,则R可能为稀盐酸
D.若①②③④都没有现象,则R可能为氢氧化钠溶液
【答案】D
【解析】
A、氢氧化钡和硫酸铜生成硫酸钡白色沉淀和氢氧化铜蓝色沉淀,若①有蓝色沉淀生成,则R可能为氢氧化钡溶液,A正确。
B、氢氧化钙是碱溶液显碱性,酚酞遇碱性溶液变红,若②溶液变红,则R可能为酚酞溶液,B正确。
C、碳酸钠和稀盐酸反应生成氯化钠二氧化碳和水,若③有气泡产生,则R可能为稀盐酸,C正确。
D、氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,若①②③④都没有现象,则R不可能为氢氧化钠溶液,D错。
故选:D。

【题目】化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。

(查阅资料)
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为:![]() 。
。
(实验一)探究灰色固体的成分
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
实验操作 |
|
|
|
|
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 | ____________ | 固体部分溶解 |
(实验二)探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号 | 盐酸浓度 | 实验现象 |
2-1 | 4.0% | 刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀 |
2-2 | 2.8% | 先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀 |
2-3 | 2.1% | 3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀 |
2-4 | 1.4% | 反应更慢,出现极少量的灰色沉淀 |
(解释与结论)
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
(反思与交流)
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。