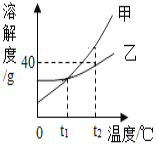
题目内容
【题目】向甲、乙两只烧杯中分别加入 100g 溶质质量分数为 7.3%的稀盐酸,然后取等质量的镁、铝单质,分别放入甲、乙两个烧杯中。充分反应后,发现甲烧杯中单质镁有剩余, 则有关该实验的说法正确的是( )
A.乙烧杯中单质铝一定没有剩余
B.铝剩余的质量一定比镁剩余的少
C.甲、乙烧杯中都产生了 0.2g 氢气
D.反应结束后甲、乙烧杯中物质的质量相等
【答案】CD
【解析】
镁、铝和盐酸反应的方程式分别为:![]() ,
,![]() ,由题意盐酸反应完,消耗HCl:100g ×7.3%=7.3g,则有以下关系:
,由题意盐酸反应完,消耗HCl:100g ×7.3%=7.3g,则有以下关系:
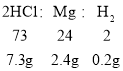

利用以上关系即可作答。
A. 加入的镁和铝的质量相等,镁反应后有剩余,从上面分析知铝的消耗更少,所以乙烧杯中单质铝也有剩余,不符合题意;
B. 从上分析知道7.3g盐酸消耗镁2.4g,7.3g盐酸消耗铝1.8g,加入金属的质量相等,所以剩余铝的质量一定比镁剩余的多,不符合题意;
C. 从分析知金属都剩余,消耗了相同的盐酸7.3g,所以甲、乙烧杯中都产生了 0.2g 氢气,符合题意;
D. 加入金属质量相等,反应产生氢气的质量也相等,反应结束后甲、乙烧杯中物质的质量相等,符合题意。故选CD。

 阅读快车系列答案
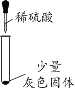
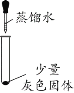
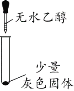
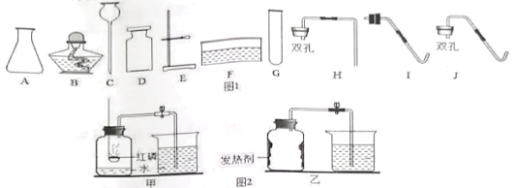
阅读快车系列答案【题目】化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。
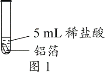
(查阅资料)
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为:![]() 。
。
(实验一)探究灰色固体的成分
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
实验操作 |
|
|
|
|
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 | ____________ | 固体部分溶解 |
(实验二)探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号 | 盐酸浓度 | 实验现象 |
2-1 | 4.0% | 刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀 |
2-2 | 2.8% | 先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀 |
2-3 | 2.1% | 3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀 |
2-4 | 1.4% | 反应更慢,出现极少量的灰色沉淀 |
(解释与结论)
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
(反思与交流)
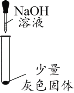
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。
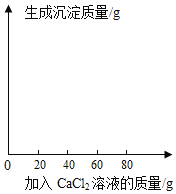
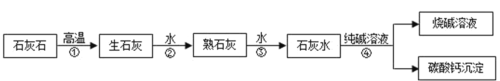
【题目】某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40 g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
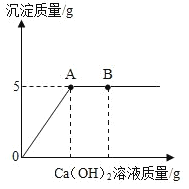
加入CaCl2溶液的质量 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 2.5g | 5g | m | 8g |
请分析表中数据并计算回答。
(1)m=________;
(2)40 g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为多少;
(3)该食用碱中Na2CO3的质量分数是?(写出计算过程,答案精确到0.1%)
(4)请根据实验四的数据画图并标上合适的坐标。