题目内容
【题目】我国制碱工业的先驱候德榜发明了“侯氏制碱法”,其生产过程涉及的主要化学反应如下:
①![]()
②![]()
③![]()
计算:
(1)反应①中X的化学式为_____
(2)工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:
①工业纯碱中碳酸钠的质量:_____
②反应后溶液中溶质的质量分数。_____
【答案】![]() 53g 20%
53g 20%
【解析】
(1)根据质量守恒定律反应前后原子的种类和数目不变,可知反应前原子的种类和数目分别是1N、3H、1C、2O,反应后是1N、5H、1C、3O,反应前后相差2个H和1个O,需要有1个X分子提供,则X的化学式为H2O,故填:H2O;
(2)根据生成的二氧化碳的质量和反应的化学方程式进行计算,
①设工业纯碱样品中含有碳酸钠的质量为x,反应生成的氯化钠的质量为y,
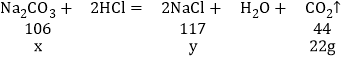
![]() 解得:x=53g,
解得:x=53g,
![]() 解得:y=58.5g
解得:y=58.5g
工业纯碱中碳酸钠的质量故填:53g;
②反应后溶液中溶质氯化钠的质量为反应生成的氯化钠和样品中原有的氯化钠,即58.5g+(55g-53g)=60.5g,反应后所得溶液质量为(55g+269.5g-22g)=302.5g,则反应后溶液中溶质的质量分数为![]() =20%,故填:20%。
=20%,故填:20%。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目