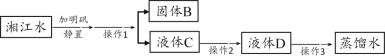题目内容
【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸的化学名称叫甲酸,化学式为HCOOH
II.蚁酸隔绝空气并加热时会分解生成两种氧化物
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有_____元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:
猜想Ⅰ是CO2;
猜想Ⅱ是_____;
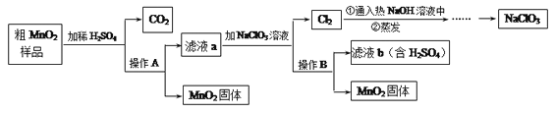
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
①先通N2的目的是__________;
②若实验过程中看到__________现象,则猜想Ⅰ不成立;
③装置B的作用是__________(用化学方程式表示);
④装置C中的现象为________;
[结论]甲酸受热能分解,反应的化学方程式是_________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________.
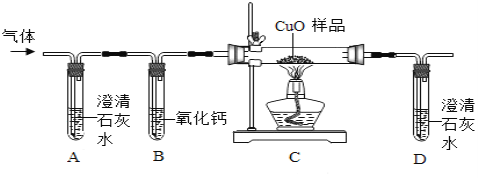
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据计算:样品中氧化铜的质量分数是多少______?(写出计算过程)
【答案】红 H、O CO 赶空气,防爆炸 A中澄清石灰水不变浑浊或A中无变化 CaO+H2O=Ca(OH)2 黑色固体变红色 HCOOH ![]() CO↑+H2O 缺少尾气处理,污染环境 80%
CO↑+H2O 缺少尾气处理,污染环境 80%
【解析】
[实验探究](1)能使石蕊试液变红色的溶液显酸性;
(2)根据质量守恒定律,蚁酸隔绝空气并加热时会分解生成水,是因为蚁酸中含有氢、氧元素;
(3)根据甲酸的元素组成,依据反应前后元素种类不变,生成水后,生成的气体可能是二氧化碳或一氧化碳;
①通入氮气是为了排净装置内的空气,防止一氧化碳不纯而爆炸;
②二氧化碳可以使澄清石灰水变浑浊,装置A中无明显变化,说明生成的气体不是二氧化碳;
③氧化钙具有吸水性,可以干燥气体,氧化钙与水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
④在加热的条件下一氧化碳与氧化铜反应生成了二氧化碳和铜,所以会看到黑色固体变红色;
[结论]甲酸受热分解为水和一氧化碳,反应的化学方程式为HCOOH ![]() H2O+CO↑;
H2O+CO↑;
[讨论交流]由于一氧化碳有毒能污染空气,从环保角度看,该装置存在明显的缺陷是缺少尾气处理,处理方法可以是:在尾部放一个燃着的酒精灯;
[拓展延伸]解:设样品中氧化铜的质量为x
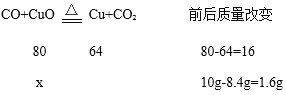
![]()
x=8.0g
样品中氧化铜的质量分数=![]() ×100%=80%
×100%=80%
答:样品中氧化铜的质量分数为80%。

【题目】I:化学是一门以实验为基础的学科,请根据图回答问题。
(1)图(a)中仪器a的名称是________;在连接c和d时,使d较容易插入c中的措施是_________;如果采用图乙的操作,可能造成的后果之一是_________。
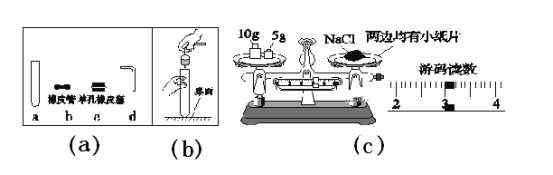
(2)图(c)是某同学称取氯化钠的操作,请你指出该同学错误操作是_________,该同学称取氯化钠的实际质量是_________g。
II:蜡烛及其燃烧的探究
实验探究步骤 | 观察物质的性质、 变化、现象 | 结论、解释 | |
⒈观察蜡烛的制作材料 | 烛芯棉线、外壳石蜡 | 由石蜡制成 | |
⒉点燃前 | (1)观察蜡烛 | 乳白色固态圆柱状 | 颜色:乳白色 状态:固态 |
(2)切一块石蜡,投入水中 | 浮在水面上,难溶于水,硬度小 | 密度________,难溶于水,硬度小 | |
⒊点 燃 蜡 烛 | (1)用火柴点燃蜡烛,观察蜡烛火焰 | 火焰分三层 | 石蜡具有可燃性,其火焰分三层 |
(2)取一根火柴,迅速平放在火焰中,1s后取出 | 火柴杆接触外焰部分变黑 | 外层温度最高,加热时应用________ | |
(3)用一干燥烧杯,罩在火焰上方,片刻,取下火焰上方的烧杯,迅速向烧杯内倒入少量石灰水,振荡 | 烧杯内壁有___________ 澄清石灰水___________ | 蜡烛燃烧生成了水和________,说明蜡烛的组成中一定有碳、氢元素,可能含有氧元素。 | |
⒋ 熄灭蜡烛 | (1)将蜡烛熄灭观察 | 有白烟产生 白烟_____(填能或者不能) 燃烧 | 白蜡烛燃烧时先由固态转变成液态,再汽化,而后燃烧; 现象中的物质白烟是___________ |