题目内容
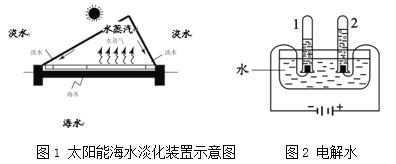
【题目】用下图所示装置测定空气中氧气的含量,其中集气瓶的容积为200mL,装有50mL水,250mL量筒内装有200mL水。
实验步骤如下(装置气密性良好,部分操作已略去):
I. 用强光手电照射,引燃足量白磷;
II. 白磷熄灭并冷却至室温,读取量筒中的水的体积;
III. 计算空气中氧气的体积分数。
(1)白磷燃烧的文字表达式为____________________________________。
(2)白磷的作用是____________________________________。
(3)集气瓶内水的主要作用是____________________________________。
(4)实验中观察到集气瓶内的液面先下降后上升,原因是____________________。
(5)此实验得出“氧气体积约占空气体积1/5”的结论,得出此结论对应的实验现象是__________________________。
(6)步骤II中,未冷却至室温就读取,会使读取的量筒中水的体积数值________ (填“偏高”、“偏低”、“相等”)。
(7)步骤Ⅱ中,读取量筒中的水的体积时,仰视,会使氧气含量的测量值_________(填“偏高”、“偏低”、“相等”)。
(8)步骤Ⅱ结束后,集气瓶中气体为__________(填“纯净物”、“混合物”)。
(9)此实验原理利用了氮气的物理性质是_______________________________。
【答案】磷+氧气![]() 五氧化二磷 燃烧,使集气瓶中氧气被完全消耗,同时生成固体 液封,防止集气瓶中气体逸出 白磷燃烧,放热,集气瓶内气体温度升高,压强增大,大于外界大气压,集气瓶中水进入导管,集气瓶中液面下降;白磷燃烧,消耗氧气,冷却到室温后,集气瓶内气体压强减小,量筒内的水倒吸入集气瓶中,集气瓶中液面上升(答温度升高和耗氧同时进行,压强在不同阶段的增大和减小的主次关系不同,给分) 量筒内液面下降到约170 mL刻度处,静止 偏高 偏高 混合物 难溶于水
五氧化二磷 燃烧,使集气瓶中氧气被完全消耗,同时生成固体 液封,防止集气瓶中气体逸出 白磷燃烧,放热,集气瓶内气体温度升高,压强增大,大于外界大气压,集气瓶中水进入导管,集气瓶中液面下降;白磷燃烧,消耗氧气,冷却到室温后,集气瓶内气体压强减小,量筒内的水倒吸入集气瓶中,集气瓶中液面上升(答温度升高和耗氧同时进行,压强在不同阶段的增大和减小的主次关系不同,给分) 量筒内液面下降到约170 mL刻度处,静止 偏高 偏高 混合物 难溶于水
【解析】
(1)白磷在空气燃烧生成五氧化二磷,反应的文字表达式为磷+氧气![]() 五氧化二磷;(2)该实验中白磷的作用是燃烧,使集气瓶中氧气被完全消耗,同时生成固体;
五氧化二磷;(2)该实验中白磷的作用是燃烧,使集气瓶中氧气被完全消耗,同时生成固体;
(3)该实验中集气瓶内水的主要作用是形成液封,防止集气瓶中气体逸出;
(4)实验中观察到集气瓶内的液面先下降后上升,原因是白磷燃烧,放热,集气瓶内气体温度升高,压强增大,大于外界大气压,集气瓶中水进入导管,集气瓶中液面下降;白磷燃烧,消耗氧气,冷却到室温后,集气瓶内气体压强减小,量筒内的水倒吸入集气瓶中,集气瓶中液面上升;
(5)若氧气体积约占空气体积1/5,集气瓶内的氧气体积=![]() ,量筒内的水倒吸入集气瓶中水的体积为30mL,量筒中液面下降到170mL。此实验得出“氧气体积约占空气体积1/5”的结论,得出此结论对应的实验现象是量筒内液面下降到约170 mL刻度处,静止;
,量筒内的水倒吸入集气瓶中水的体积为30mL,量筒中液面下降到170mL。此实验得出“氧气体积约占空气体积1/5”的结论,得出此结论对应的实验现象是量筒内液面下降到约170 mL刻度处,静止;
(6)步骤II中,未冷却至室温就读取,瓶内有气压偏大,进入集气瓶中水的体积偏小,会使读取的量筒中水的体积数值偏高;
(7)步骤Ⅱ中,读取量筒中的水的体积时,仰视,读数偏小,会使氧气含量的测量值偏高;
(8)步骤Ⅱ结束后,只是消耗了氧气,集气瓶中气体还有氮气、二氧化碳、稀有气体等,属于混合物;
(9)燃烧结束后,集气瓶内剩余的气体主要是氮气,氮气难溶于水,液面不再上升,此实验原理利用了氮气的物理性质是难溶于水。

【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体,该反应的化学方程式为__________;但她在空气中点燃镁条时,发现生成的白色固体中还夹杂着少量的淡黄色固体。
(提出问题)为什么会生成淡黄色固体?
(查阅资料)小婧查阅资料,记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 |
其他同学认为不需要查询________的颜色,理由是__________。
(提出猜想)分析资料,小茜认为淡黄色固体可能是由镁与空气中的氮气反应生成的。
(实验探究)
实验操作 | 实验现象 | 实验结论和化学方程式 |
__________ | ______ | 小茜的猜想成立,化学方程式为 _________。 |