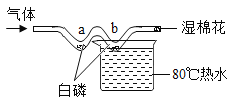
题目内容
【题目】NaNO2(亚硝酸钠)、NaCl 和物质M(不含结晶水)的溶解度曲线如图①所示,请根据图象和有关信息回答下列问题:
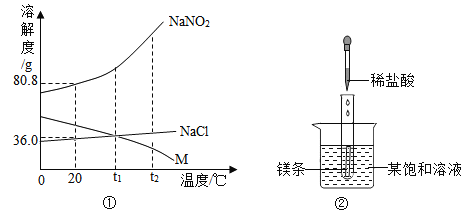
(1)t2℃时,NaNO2、NaCl和M的溶解度由大到小的顺序是_____.如图②所示,当往试管中加入5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断:该饱和溶液中的溶质是NaNO2、NaCl 和M 中的_____.
(2)分别将NaNO2、NaCl 和M 的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质质量分数由大到小的顺序是_____;
(3)NaNO2有毒,其外观和咸味与食盐很相似,因此要防止因误食NaNO2而发生中毒事故.为了区别NaNO2、NaCl固体,某化学兴趣小组同学查阅资料获得如下信息:NaNO2的水溶液呈碱性,NaCl的水溶液呈中性;NaNO2熔点为271℃,NaCl熔点为801℃.
①小明同学设计的鉴别实验方案如下:20℃时分别取NaNO2、NaCl5.0g于两只小烧杯中,分别加入8mL水(水的密度近似看做1g/cm3),用玻璃棒充分搅拌后观察.你认为此方案是否可行_____.
②该小组其他同学又设计出与小明不同的实验方案,并获得成功.你认为该方案可能是:_____.
【答案】NaNO2>NaCl>M M NaNO2>NaCl>M 可行 分别取少量样品于试管中,加水溶解,滴加无色酚酞试液,变红者为NaNO2,不变者为NaCl(分别取少量的NaNO2、NaCl固体于两支试管中,用酒精灯加热,熔化者为NaNO2,不熔者为NaCl)
【解析】
(1)由三物质的溶解度曲线可知,在t2℃时,三物质的溶解度大小关系是NaNO2>NaCl>M;
镁与稀盐酸反应放出大量的热,使烧杯内温度升高,由题意可知,升温时该物质的饱和溶液中出现浑浊,说明该物质的溶解度随温度的升高而减小,故该饱和溶液中的溶质是M;
(2)由图可知,NaNO2、NaCl的溶解度随温度的升高而增加,M的溶解度随温度的升高而减小,故分别将NaNO2、NaCl 和M 的饱和溶液从t2℃降温到t1℃时,NaNO2、NaCl还是饱和溶液,M变为不饱和溶液,降温后,M的溶质质量分数不变,t1℃时,NaNO2的溶解度大于NaCl的溶解度大于t2℃时,M的溶解度,故t1℃时,NaNO2饱和溶液的溶质质量分数大于该温度下,NaCl的饱和溶液的溶质质量分数,大于t2℃时,M的饱和溶液的溶质质量分数,故分别将NaNO2、NaCl 和M 的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质质量分数由大到小的顺序是:NaNO2>NaCl>M;
(3)由图可知,20℃时,NaNO2、NaCl的溶解度分别为80.8g和36g,即20℃时,10g水中最多能溶解8.08g亚硝酸钠,该温度下,10g水最多能溶解3.6g氯化钠,故向8ml水中加入5g两种物质,能全部溶解的是NaNO2;不能全部溶解的是氯化钠;故方案可行;
由于NaNO2熔点为271℃,NaCl熔点为801℃,还可以选用分别取少量的NaNO2、NaCl固体于两支试管中,用酒精灯加热,熔化者为NaNO2,不熔者为NaCl;
由于NaNO2的水溶液呈碱性,NaCl的水溶液呈中性,还可以分别取少量样品于试管中,加水溶解,滴加无色酚酞试液,变红者为NaNO2,不变者为NaCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案