题目内容
【题目】小明和小芳同学在实验室中发现了一瓶敞口放置的固体烧碱,经推测该烧碱已经变质。写出烧碱发生变质反应的化学方程式:_____。若检验烧碱已经变质了,可用的试剂除了稀盐酸或氯化钡溶液等,还可以用_____(要求写出另一种类别的物质)。
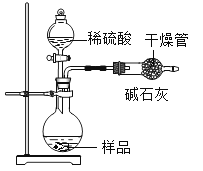
[提出问题]该固体烧碱中变质的量是多少呢?
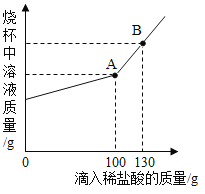
[设计实验]小芳设计了如图所示装置,通过实验数据来计算。她称取5g样品与足量的稀盐酸反应,称量反应前后球形干燥管(干燥管内碱石灰是CaO和NaOH的混合物)的质量,测定出产生二氧化碳的质量。
[交流讨论]小明认为,小芳设计的实验装置存在缺陷,若导致实验结果偏大,则该装置的主要缺陷是_____。(答一点)
[拓展探究]在老师的点拨下,他们又设计了如图所示的方案来测定该固体烧碱中变质的量:
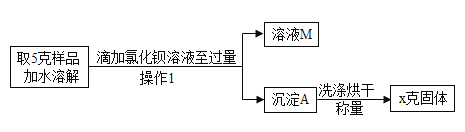
(1)操作“1”的名称是_____,沉淀A是_____。
(2)确定滴加BaCl2溶液是否过量的方法是_____。
【答案】![]() 氢氧化钡溶液(或氢氧化钙溶液) 产生的二氧化碳气体中含有水蒸气,同时被碱石灰吸收(或球形干燥管与空气相通,也会吸收空气中的二氧化碳和水蒸气)(合理即可) 过滤 碳酸钡(或BaCO3) 向溶液M中加入氯化钡溶液,不再产生沉淀
氢氧化钡溶液(或氢氧化钙溶液) 产生的二氧化碳气体中含有水蒸气,同时被碱石灰吸收(或球形干燥管与空气相通,也会吸收空气中的二氧化碳和水蒸气)(合理即可) 过滤 碳酸钡(或BaCO3) 向溶液M中加入氯化钡溶液,不再产生沉淀
【解析】
烧碱就是氢氧化钠,氢氧化钠露置于空气中能与二氧化碳反应生成碳酸钠和水而变质,故反应的化学方程式写为:2NaOH+CO2=Na2CO3+H2O。
常见的碱,如氢氧化钡或氢氧化钙均能与变质后生成的碳酸钠反应生成碳酸钡或碳酸钙的白色沉淀,能够说明烧碱已变质,故填氢氧化钡溶液(或氢氧化钙溶液)。
{交流讨论}球形干燥管中的碱石灰既能吸收生成的二氧化碳,也能吸收生成的二氧化碳中混有的水蒸气,由于球形干燥管中的碱石灰直接与空气接触,还会吸收空气中的二氧化碳与水蒸气,使得测出的二氧化碳的质量偏大,最终计算出的变质的氢氧化钠质量偏大,故填产生的二氧化碳气体中含有水蒸气,同时被碱石灰吸收(或球形干燥管与空气相通,也会吸收空气中的二氧化碳和水蒸气)。
{拓展探究}(1)操作1将溶液与沉淀进行了分离,能把溶液与难溶性固体分离的操作是过滤,即操作1是过滤,故填过滤;
氯化钡与氢氧化钠变质生成的碳酸钠反应生成碳酸钡沉淀和氯化钠,所以沉淀A是碳酸钡,碳酸钡的化学式为BaCO3,故填碳酸钡(或BaCO3)。
(2)氯化钡能与碳酸钠反应生成碳酸钡沉淀,所以确定滴加BaCl2溶液是否过量的方法是向溶液M中加入氯化钡溶液,不再产生沉淀,说明加入的氯化钡已经过量,故填向溶液M中加入氯化钡溶液,不再产生沉淀。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案