题目内容
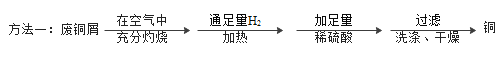
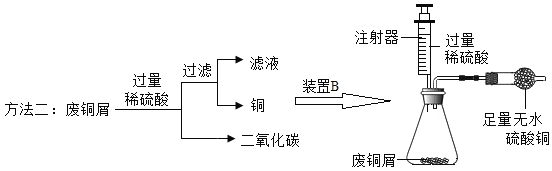
【题目】“垃圾是放错位置的资源”,废旧金属的回收利用可节约资源、减少污染。为测定某废铜屑(含铜、铜锈、氧化锌)中铜元素的含量,以便合理回收金属,化学小组取一定质量的样品,分别用如下方法获取相关数据。
(查阅资料)铜锈的成分为碱式碳酸铜[![]() ];
];![]()
![]()
(设计与实验)
(实验分析)
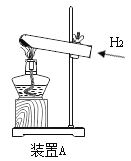
方法一:在装置A中添加用于通入H2的玻璃导管_______;加足量稀硫酸反应的化学方程式是______。
方法二:装置B中“足量无水硫酸铜”的作用是______;过滤后滤液中的溶质是______。此步骤还可证明锌的金属活动性比铜强,理由是_______。实验中,待锥形瓶内的反应结束后,可用注射器向瓶内多次来回推入空气,其目的是_______。为测定废铜屑中铜元素的含量,结合图中装置需要称量并记录的数据有_______、______。
(实验反思)
通过分析写出方法二比方法一的一条不足_______。
【答案】 ZnO+H2SO4=H2O+ZnSO4 吸收水分,避免水挥发使质量减小,影响对二氧化碳质量的测量,从而影响对铜锈中铜质量的计算 ZnSO4、H2SO4、CuSO4 最后剩余铜,没有和ZnSO4反应 保证反应产生的二氧化碳全部排出装置 过滤后得到的铜的质量 装置B前后质量的减少量 回收铜的质量偏少(其他合理答案也可)
ZnO+H2SO4=H2O+ZnSO4 吸收水分,避免水挥发使质量减小,影响对二氧化碳质量的测量,从而影响对铜锈中铜质量的计算 ZnSO4、H2SO4、CuSO4 最后剩余铜,没有和ZnSO4反应 保证反应产生的二氧化碳全部排出装置 过滤后得到的铜的质量 装置B前后质量的减少量 回收铜的质量偏少(其他合理答案也可)
【解析】
方法一:为了在反应前,能将试管中的空气全部排出,防止爆炸,反应完后,能充分冷却还原产物,避免铜被氧化,所以在装置A中用于通入H2的玻璃导管需要伸入试管底部,氧化铜的上方,如图: ;根据流程可知,通入氢气后加热,固体中有铜和锌,铜与硫酸不能反应,锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4=H2↑+ZnSO4;
;根据流程可知,通入氢气后加热,固体中有铜和锌,铜与硫酸不能反应,锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4=H2↑+ZnSO4;
方法二:无水硫酸铜可以用来检验水蒸气或吸收少量水蒸气,装置中加入的是足量的无水硫酸铜,因此可以用来吸收水分,避免水挥发使质量减小,影响对二氧化碳质量的测量,从而影响对铜锈中铜质量的计算;铜锈和稀硫酸反应过程中有硫酸铜生成,氧化锌和稀硫酸反应过程中有硫酸锌生成,稀硫酸又是过量的,因此滤液中含有ZnSO4、H2SO4、CuSO4;在滤液中有ZnSO4,滤渣中有Cu,这个过程中Cu并没有将溶液中的ZnSO4置换出来,说明Cu比Zn的活动性弱;往注射器向瓶内多次来回推入空气可将反应中产生的二氧化碳全部排出装置,防止影响对二氧化碳质量的测量;要测定出废铜屑中铜元素的含量,必须测出装置B前后质量的减少量(质量差即为反应生成二氧化碳气体的质量,根据二氧化碳质量和反应的化学方程式可以计算反应生成硫酸铜质量,进一步可以计算硫酸铜中铜元素质量)以及过滤后得到的铜的质量,进一步可以计算出铜元素质量的含量。故填: 吸收水分,避免水挥发使质量减小,影响对二氧化碳质量的测量,从而影响对铜锈中铜质量的计算;ZnSO4、H2SO4、CuSO4;最后剩余铜,没有和ZnSO4反应;保证反应产生的二氧化碳全部排出装置;过滤后得到的铜的质量;装置B前后质量的减少量。
[实验反思]方法一中的铜元素到最后全部转化成了铜单质,而方法二中滤液中还有部分硫酸铜并未回收回去,故填:回收铜的质量偏少(其他合理答案也可)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】各组物质不能按照关系图(其中“→”表示反应一步完成)相互转化的是
选项 | A | B | C | D |
|
|
|
| |
甲 | C | CaO | KOH | BaCO3 |
乙 | CO | CaCl2 | KCl | BaCl2 |
丙 | CO2 | CaCO3 | KNO3 | Ba(NO3)2 |
A.AB.BC.CD.D
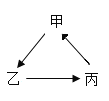
【题目】甲、乙、内三种物质的转化关系见下面如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是( )
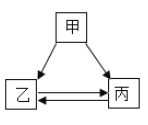
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | NaOH | NaCl | NaNO3 |
C | Na2O | NaOH | Na2CO3 |
D | Ca(OH)2 | CaCl2 | CaCO3 |
A. AB. BC. CD. D