题目内容
【题目】某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
部分钙、镁化合物溶解性表(20℃) | |||
| OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
(查阅资料) 天然水中含有![]() 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
(提出猜想)水垢的主要成分一定有CaCO3和_____(填化学式),可能含有Ca(OH)2和_____。
(设计方案)
实验1 确定水垢中是否含有 Ca(OH)2
实验步骤 | 现象 | 结论 |
在少量研体的水垢中,加入适量的蒸馏水充分搅拌、过滤,在滤液中加入Na2CO3溶液 | ___________ | 一定不含Ca(OH)2 |
实验2:确定水垢中是否含MgCO3
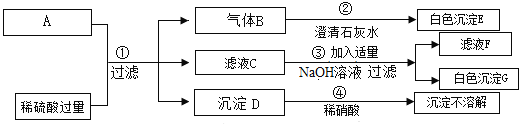
利用下列实验装置,完成实验2探究。

其主要实验步骤如下:称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要分为CaO和NaOH,不考虑装置内空气对实验的影响)。
(实验讨论)
(1)反应结束后打开止水夹K,缓缓鼓入空气的目的是___________。A、B装置之间__________设置干燥装置。(填“要”或“不要”)其理由是____________。
(2)装置B盛放稀盐酸的仪器作用是_________________。
(3)装置B中生成气体的反应的化学方程式为_______________。
(4)装置B中生成CO2的质量为_________g,通过计算说明水垢中_________含MgCO3(填字母)。
A 一定不 B 一定 C 可能 D 无法确定
计算过程(已知CaCO3相对分子质量为100。MgCO3相对分子质量为84):___________
实验3:确定水垢中是否有Mg(OH)2
(5)另取质量为1.25g水垢,加入3.65%稀盐酸与之反应,测得消耗稀盐酸mg,结合上述实验,判断当m的值满足____________条件时,水垢中一定含有Mg(OH)2。写出计算过程。
【答案】Mg(OH)2 MgCO3 无沉淀产生 将残留在装置中的二氧化碳全部排入D、E装置中充分吸收 不要 C装置可以除去二氧化碳的水蒸气 控制反应的速率 CaCO3+2HCl=CaCl2+H2O+CO2↑ 1.25 B 碳酸钙的质量为2.84g,而水垢的质量为2.5g,故一定含有能生成二氧化碳的碳酸镁存在。 m>56.8。
【解析】
提出猜想:
根据表格提供的物质的溶解性,可以推出水垢的主要成分一定有CaCO3和Mg(OH)2(不溶),可能含有Ca(OH)2和MgCO3(微溶)。
设计方案1:
碳酸钠能与氢氧化钙反应产生白色沉淀,不含有氢氧化钙,则加入碳酸钠不会观察到有沉淀产生;
(1)反应结束后打开止水夹K,缓缓鼓入空气是为了将残留在装置中的二氧化碳全部排入D、E装置中充分吸收。由于C装置可以除去二氧化碳的水蒸气,故A、B装置之间 不要设置于干燥装置;
(2)剧图可以看出,装置B盛放稀盐酸的仪器是分液漏斗,能控制液体的滴加速度,从而控制反应的速率,
(3)装置B中碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(4)解:装置B中生成的二氧化碳的质量为201.25g-200g=1.25g,设碳酸钙的质量为x,
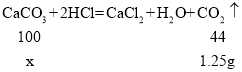
![]()
x=2.84g,
而水垢的质量为2.5g,故一定含有能生成二氧化碳的碳酸镁存在。
(5)由实验2可知:2.5g水垢与盐酸反应生成1.25g二氧化碳;据碳酸钙、碳酸镁与盐酸反应方程式可知生成1.25g二氧化碳恰好需要3.65%的稀盐酸的质量;设需要稀盐酸的质量是x,由CaCO3+2HCl=CaCl2+H2O+CO2↑,MgCO3+2HCl=MgCl2+H2O+CO2↑可知:

![]()
x=56.8g
由CaCO3+2HCl=CaCl2+H2O+CO2↑,MgCO3+2HCl=MgCl2+H2O+CO2↑,Mg(OH)2+2HCl=MgCl2+2H2O可知:
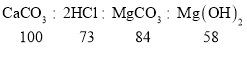 可知:等质量的碳酸镁、碳酸钙、氢氧化镁,氢氧化镁消耗盐酸质量最多,所以当实际消耗盐酸质量大于56.8时,水垢中一定含有氢氧化镁。
可知:等质量的碳酸镁、碳酸钙、氢氧化镁,氢氧化镁消耗盐酸质量最多,所以当实际消耗盐酸质量大于56.8时,水垢中一定含有氢氧化镁。

 怎样学好牛津英语系列答案
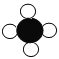
怎样学好牛津英语系列答案【题目】微观构成是我们学习化学的一个重要组成。甲、乙、丙、丁四种物质,其化学式和微观构成微粒示意图分别列于下表:
物质 | 甲 | 乙 | 丙 | 丁 | 图例:
|
化学式 | CH4 | C | ? | H2 | |
围观示意图 |
|
|
|
|
(1)甲在高温条件下会生成乙和丁,请写出相应的符号表达式_____。
(2)能保持丁物质化学性质的微粒名称是_____。
(3)元素以游离态在的物质是_____(填“甲、乙、丙、丁”)。
(4)某物质中经查只有H、O两种元素组成,则该物质_____(一定/不一定)是纯净物。
【题目】除去下列物质中的少量杂质(括号里为杂质),所选试剂及操作方法均正确的是( )
选项 | 物质(括号内物质为杂质) | 选用试剂 | 操作方法 |
A |
| 适量稀盐酸 | 溶解、过滤、洗涤、干燥 |
B |
| 过量O2 | 点燃 |
C | 稀盐酸(H2SO4) | 适量Ba(NO3)2溶液 | 过滤 |
D | NaCl 溶液 (BaCl2) | 适量Na2CO3溶液 | 过滤 |
A.AB.BC.CD.D