题目内容
【题目】下图表示的实验方案设计,不能达到实验目的的是( )
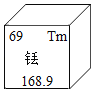
A. 探究燃烧的条件
探究燃烧的条件
B.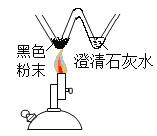 探究木炭还原氧化铜
探究木炭还原氧化铜
C.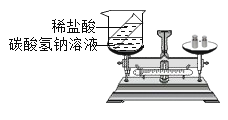 探究质量守恒定律
探究质量守恒定律
D. 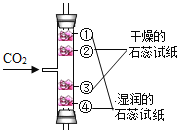 探究CO2能与水反应且密度比空气大
探究CO2能与水反应且密度比空气大
【答案】C
【解析】
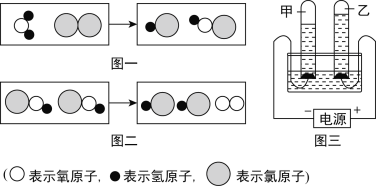
A、管中的白磷燃烧,水中的白磷不能燃烧,说明燃烧需要氧气,红磷不能燃烧,说明燃烧需要温度达到可燃物着火点,该选项能够达到实验目的,故A正确;
B、过程中黑色固体变红色,澄清石灰水变浑浊,说明氧化铜和碳反应生成了铜和二氧化碳,通过实验可以探究木炭还原氧化铜,故B正确;
C、稀盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,生成气体逸出到空气中,探究质量守恒定律必须在密闭仪器中进行,故C不正确;
D、二氧化碳不能使紫色石蕊试液变色,二氧化碳和水反应生成的碳酸可以使紫色石蕊试液变化,①④变色且④先变色,说明CO2能与水反应且密度比空气大,故D正确。故选C。

【题目】某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
部分钙、镁化合物溶解性表(20℃) | |||
| OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
(查阅资料) 天然水中含有![]() 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
(提出猜想)水垢的主要成分一定有CaCO3和_____(填化学式),可能含有Ca(OH)2和_____。
(设计方案)
实验1 确定水垢中是否含有 Ca(OH)2
实验步骤 | 现象 | 结论 |
在少量研体的水垢中,加入适量的蒸馏水充分搅拌、过滤,在滤液中加入Na2CO3溶液 | ___________ | 一定不含Ca(OH)2 |
实验2:确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。

其主要实验步骤如下:称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要分为CaO和NaOH,不考虑装置内空气对实验的影响)。
(实验讨论)
(1)反应结束后打开止水夹K,缓缓鼓入空气的目的是___________。A、B装置之间__________设置干燥装置。(填“要”或“不要”)其理由是____________。
(2)装置B盛放稀盐酸的仪器作用是_________________。
(3)装置B中生成气体的反应的化学方程式为_______________。
(4)装置B中生成CO2的质量为_________g,通过计算说明水垢中_________含MgCO3(填字母)。
A 一定不 B 一定 C 可能 D 无法确定
计算过程(已知CaCO3相对分子质量为100。MgCO3相对分子质量为84):___________
实验3:确定水垢中是否有Mg(OH)2
(5)另取质量为1.25g水垢,加入3.65%稀盐酸与之反应,测得消耗稀盐酸mg,结合上述实验,判断当m的值满足____________条件时,水垢中一定含有Mg(OH)2。写出计算过程。