题目内容
【题目】用化学符号表示:
(1)两个钙原子______; (2)4个二氧化硫分子______;
(3)水______; (4)2个亚铁离子______;
(5)氧化镁中的镁元素呈正二价______;(6)两个碳酸根离子______;
(7)氧化钠:______; (8)氢氧化钙:______。
【答案】2Ca 4SO2 H2O 2Fe2+ ![]() 2CO32- Na2O Ca(OH)2
2CO32- Na2O Ca(OH)2
【解析】
(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。所以两个钙原子,就可表示为:2Ca;
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则4个二氧化硫分子可表示为:4SO2;
(3)水是由显+1价的氢元素和显-2价的氧元素组成的,根据化合价原则,其化学式可表示为:H2O;
(4)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字,故2个亚铁离子可表示为:2Fe2+;
(5)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式中该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化镁中的镁元素呈正二价,故可表示为:![]() ;
;
(6)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.但碳酸根离子是由多个原子组成的离子,整体带2个单位的负电荷,表示为CO32-,若表示多个该离子,就在其元素符号前加上相应的数字,故2个碳酸根离子可表示为:2CO32-;
(7)氧化钠中,钠元素的化合价是+1,氧元素的化合价是-2,化学式Na2O;
(8)氢氧化钙中钙元素显+2价,氢氧根显-1价,其化学式为Ca(OH)2。

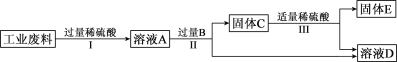
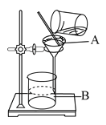
【题目】某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
部分钙、镁化合物溶解性表(20℃) | |||
| OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
(查阅资料) 天然水中含有![]() 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
(提出猜想)水垢的主要成分一定有CaCO3和_____(填化学式),可能含有Ca(OH)2和_____。
(设计方案)
实验1 确定水垢中是否含有 Ca(OH)2
实验步骤 | 现象 | 结论 |
在少量研体的水垢中,加入适量的蒸馏水充分搅拌、过滤,在滤液中加入Na2CO3溶液 | ___________ | 一定不含Ca(OH)2 |
实验2:确定水垢中是否含MgCO3
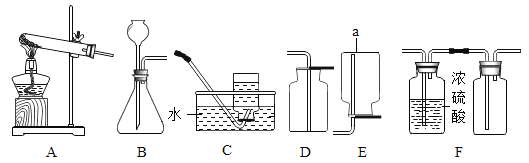
利用下列实验装置,完成实验2探究。

其主要实验步骤如下:称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要分为CaO和NaOH,不考虑装置内空气对实验的影响)。
(实验讨论)
(1)反应结束后打开止水夹K,缓缓鼓入空气的目的是___________。A、B装置之间__________设置干燥装置。(填“要”或“不要”)其理由是____________。
(2)装置B盛放稀盐酸的仪器作用是_________________。
(3)装置B中生成气体的反应的化学方程式为_______________。
(4)装置B中生成CO2的质量为_________g,通过计算说明水垢中_________含MgCO3(填字母)。
A 一定不 B 一定 C 可能 D 无法确定
计算过程(已知CaCO3相对分子质量为100。MgCO3相对分子质量为84):___________
实验3:确定水垢中是否有Mg(OH)2
(5)另取质量为1.25g水垢,加入3.65%稀盐酸与之反应,测得消耗稀盐酸mg,结合上述实验,判断当m的值满足____________条件时,水垢中一定含有Mg(OH)2。写出计算过程。