题目内容
【题目】某化学兴趣小组在探究氢氧化钠的化学性质时,做了如图一所示的 A、B、C 三个实验。
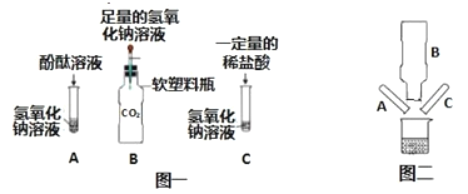
(1)写出实验B中反应的化学方程式_____。
(2)实验结束后,小组同学将 A、B、C 三容器中的废液同时倒入一个洁净的烧杯中(如图二所示),产生_____现象,并最终得到无色溶液。同学们对所得溶液的溶质成分(不考虑指示剂)进行探究。
(查阅资料)初中常见物质溶液的pH
稀盐酸 | 氯化钠 | 碳酸钠 | 氢氧化钠 | |
溶液的 pH | <7 | =7 | >7 | >7 |
(提出猜想)甲同学猜想:溶液中溶质为 NaCl。
乙同学猜想:溶液中溶质为 NaCl、_____(填化学式,下同)。
(设计实验)设计实验证明猜想。
实验步骤 | 实验现象 | 实验结论 |
取少量溶液于试管中,加入_____。 | 溶液变为蓝色。 | 乙同学的猜想成立。 |
(反思与总结)判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑_____。
【答案】2NaOH + CO2 = Na2CO3 + H2O 无色气泡 HCl CuO(其他合理答案也给分) 反应物是否过量
【解析】
(1)实验 B 中将足量的氢氧化钠溶液加入到装有二氧化碳的塑料瓶中,氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH + CO2 = Na2CO3 + H2O;
(2)实验结束后,A中含有氢氧化钠(红色),B中含有碳酸钠,C中含有氯化钠,可能含有盐酸,将A、B、C混合,最终得到无色溶液,说明C中一定含有盐酸,盐酸和氢氧化钠、碳酸钠发生了反应,使红色溶液变为无色。盐酸与碳酸钠反应生成二氧化碳气体,所以现象为有无色气泡产生;
[提出猜想]由于混合后溶液变为无色,说明溶液呈中性或酸性,所以溶液中的溶质含有NaCl或NaCl、HCl,答案为:HCl;
[设计实验]根据实验现象和实验结论推断实验过程,实验现象为溶液变为蓝色,说明溶液中含有Cu2+,加入的物质一定含有铜元素,实验结论证明乙猜想正确,说明溶液中含有NaCl和HCl,因此推断加入的物质为CuO;
[反思与总结]通过以上实验可以发现,反应后溶液中溶质HCl是C实验的反应物,因此判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑反应物是否过量。

【题目】家庭中常用洁厕剂的有效成分是盐酸,小明同学想测定某品牌洁厕剂中氯化氢的质量分数.他将足量的石灰石加入洁厕剂样品中(石灰石中的杂质既不与酸反应,也不溶于水),有关实验数据见表:
反应前 | 反应后 | ||
实验数据 | 洁厕剂样品的质量 | 加入石灰石的质量 | 剩余物的总质量 |
73g | 50g | 114.2g | |
请计算:
(1)反应后生成二氧化碳的质量为_____.
(2)该洁厕剂中氯化氢的质量分数._____