��Ŀ����
����Ŀ����ͥ�г��ý������Ч�ɷ������ᣬС��ͬѧ��ⶨijƷ�ƽ�����Ȼ������������������������ʯ��ʯ��������Ʒ�У�ʯ��ʯ�е����ʼȲ����ᷴӦ��Ҳ������ˮ�����й�ʵ�����ݼ�����
��Ӧǰ | ��Ӧ�� | ||
ʵ������ | �����Ʒ������ | ����ʯ��ʯ������ | ʣ����������� |
73g | 50g | 114.2g | |
����㣺
��1����Ӧ�����ɶ�����̼������Ϊ_____��
��2���ý�����Ȼ��������������_____
���𰸡�8.8g 20%
��������
ʯ��ʯ����Ҫ�ɷ�̼�����ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���������غ㶨�ɣ��������ٵ����������ɵĶ�����̼�������ݴ˸��ݷ�Ӧ�Ļ�ѧ����ʽ��ʽ������μӷ�Ӧ��ϡ���������ʵ�����������������ý�����Ȼ��������������
��1����Ӧ�����ɶ�����̼������Ϊ73g+50g��114.2g��8.8g��
��2����μӷ�Ӧ�Ľ���������Ȼ��������Ϊx��
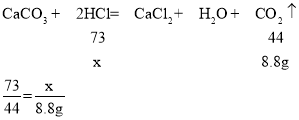
x��14.6g
�ý�����Ȼ������������Ϊ![]() ��100%��20%��
��100%��20%��
�𣺣�1��8.8g����2���ý�����Ȼ������������Ϊ20%��

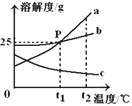
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��ѧ��ȤС����̽���������ƵĻ�ѧ����ʱ��������ͼһ��ʾ�� A��B��C ����ʵ�顣
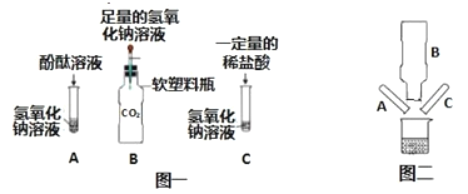
��1��д��ʵ��B�з�Ӧ�Ļ�ѧ����ʽ_____��
��2��ʵ�������С��ͬѧ�� A��B��C �������еķ�Һͬʱ����һ���ྻ���ձ��У���ͼ����ʾ��������_____�������յõ���ɫ��Һ��ͬѧ�Ƕ�������Һ�����ʳɷ֣�������ָʾ��������̽����
���������ϣ����г���������Һ��pH
ϡ���� | �Ȼ��� | ̼���� | �������� | |
��Һ�� pH | ��7 | ��7 | ��7 | ��7 |
��������룩��ͬѧ���룺��Һ������Ϊ NaCl��
��ͬѧ���룺��Һ������Ϊ NaCl��_____���ѧʽ����ͬ����
�����ʵ�飩���ʵ��֤�����롣
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У�����_____�� | ��Һ��Ϊ��ɫ�� | ��ͬѧ�IJ�������� |
����˼���ܽᣩ�жϷ�Ӧ����Һ�����ʵijɷ֣���Ҫ�����������⣬���迼��_____��
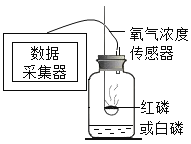
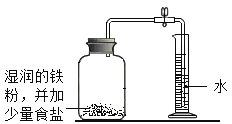
����Ŀ�����������ʵ��̽����
��ʵ��̽����
ʵ������ | ��¼���� |
A���������ʹ����豸̽�����ס������ڿ�����ȼ��ʱ�ĺ������
| ȼ�պ��ף�ƿ��ʣ���������������Ϊ8.85% ȼ�հ��ף�ƿ��ʣ���������������Ϊ3.21% |
B����������ԭ���ⶨ�������������������
| ��Ӧǰ�ⶨ������ƿ�ݻ�(�۳�ҩƷ�����ܺ�ƿ����ռ�ݻ�)Ϊ125.0mL ��Ӧ��ⶨ��������ƿ��ˮ����� Ϊ25.0mL |
(1)���Ͱ���������ͬ����Ԫ����ɵIJ�ͬ___(����������������������)������Aʵ��ʱ��ȼ�շ�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ___��
(2)ʵ��A�IJⶨ������ڲ�������װ�ò�©�������ס���������������µõ��ģ����ȼ�������ĽǶ�˵�����ס�����������ϴ����Ҫԭ��___��
(3)ʵ��B�У���������Ϊ�ӿ�ʵ����̶���ȡ�Ĵ�ʩ��___��___(�����ֱ��)��
���ڼ���ƿ�н��� ������ƿ����©����ʹ�����۶���ʹ����˿�ܼ�����ʳ��
(4)�������ʵ��������___(д��ѧʽ)�����˻�ѧ��Ӧ�����ݱ��м�¼���ݣ��ɼ�����������������������Ϊ___��
����˼����չ��ͭ�ڳ�ʪ�Ŀ���������ͭ�̣���ѧʽΪCu2(OH)2CO3��ʱҲ�ܺ������ӻ�ѧʽ���Կ�����ͭ�̵�������ͭ��ˮ�������е�___������Ӧ�Ĺ��̣����ԣ�ʵ��B___(������������������)��ͭ�۴������ۡ�