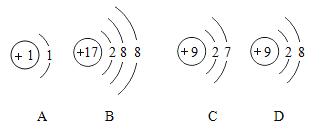
题目内容
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种氢氧化物沉淀物,并通过系列处理得到有价值的产品。操作流程如下图所示:
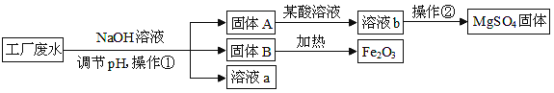
(1)固体A与某酸反应的化学方程式为____。进行操作②,当__时,即可停止加热。
(2)固体B加热时的产物是两种常见氧化物,则另一种氧化物的化学式为____。
(3)溶液a除了可能含有NaOH外,还一定有的溶质是____(填化学式)。
【答案】Mg(OH)2+H2SO4=MgSO4+2H2O 较多量固体析出 H2O NaCl、Na2SO4
【解析】
某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,NaOH会与MgSO4反应生成Mg(OH)2沉淀和Na2SO4,NaOH会与FeCl3反应生成Fe(OH)3沉淀和NaCl,从流程图可知固体B加热后生成Fe2O3,知固体B是Fe(OH)3沉淀,固体A是Mg(OH)2沉淀,溶液b经过操作变为MgSO4固体,可知溶液b是MgSO4溶液,是固体A加入硫酸反应生成。
(1)固体A是Mg(OH)2,溶液b是MgSO4溶液,是Mg(OH)2和硫酸反应生成,反应的化学方程式:![]() ,操作②是将MgSO4溶液变为MgSO4固体,因此操作②是蒸发,在蒸发操作中当出现较多固体析出时,停止加热,利用蒸发皿的余热将剩余液体蒸干。故填:
,操作②是将MgSO4溶液变为MgSO4固体,因此操作②是蒸发,在蒸发操作中当出现较多固体析出时,停止加热,利用蒸发皿的余热将剩余液体蒸干。故填:![]() ,较多量固体析出。
,较多量固体析出。
(2)固体B是Fe(OH)3沉淀,加热时的产物是两种常见氧化物,一种是氧化铁,根据质量守恒定律元素种类守恒知,另一种氧化物中含氢元素,是水,化学式是H2O,故填:H2O。
(3)溶液a除了可能含有NaOH外,加入的NaOH会与MgSO4反应生成Mg(OH)2沉淀和Na2SO4,NaOH会与FeCl3反应生成Fe(OH)3沉淀和NaCl,经过滤后,Na2SO4和NaCl进入溶液a,因此溶液a中一定含有的溶质是Na2SO4和NaCl,故填:Na2SO4、NaCl。

【题目】某学生在一定温度下,向质量均为 100g 的四份水中分别加入一定质量的 KNO3固体,搅拌至充分溶解(如有不能溶解的 KNO3,则过滤除去),得到溶液,该学生在实验 中记录的数据如下:
实验序号 | 实验 1 | 实验 2 | 实验 3 | 实验 4 |
水的质量(g) | 100 | 100 | 100 | 100 |
加入 KNO3 的质量(g) | 80 | 100 | 120 | 140 |
溶液质量(g) | 180 | 200 | 210 | 210 |
(1)根据上述数据分析,实验______________和_____________得到饱和溶液。
(2)KNO3 饱和溶液的质量分数是_____________。(取整数)
(3)该温度下 KNO3 的溶解度是_____________g ( g/100g 水)o