题目内容
【题目】某校化学兴趣小组的同学在老师的指导下做了有关氧气系列探究实验:
探究一:学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:CuO(氧化铜)能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想)Ⅰ.CuO不是过氧化氢分解反应的催化剂 Ⅱ.CuO是过氧化氢分解反应的催化剂。
(实验)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
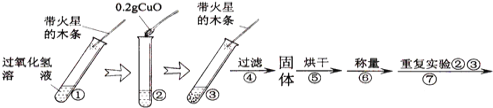
(1)
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__________ | __________ | 溶液中有气泡放出,______ | 猜想Ⅰ不成立; 猜想Ⅱ成立. |
(2)能证明CuO加快了过氧化氢分解速率的实验步骤是_________________。
(3)步骤⑦的目的是________________________。
探究二:对空气中氧气含量的测定实验进行探究:
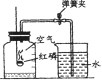
某化学兴趣小组对教材中“测定空气里氧气含量”的实验(见图Ⅰ)进行了大胆改进,设计(如图 Ⅱ)(选用容积为40mL试管作反应容器)实验方案进行,收到了良好的效果。请你对比分 析下面图Ⅰ、图Ⅱ实验,回答下列有关问题:
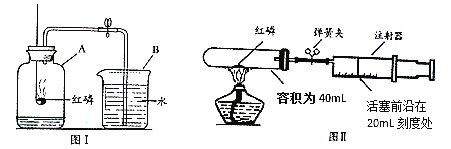
(1)图Ⅰ实验中:红磷在空气中燃烧(如图);该反应的文字表达式___;
(2)图Ⅱ实验中:
①实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明___________________;
②图Ⅱ实验,若打开弹簧夹,用酒精灯加热红磷,从红磷燃烧到熄灭冷却的实验过程中,注射器活塞将___________________移动,最终约停止在____mL刻度处。
(3)反思:小林同学利用图Ⅰ装置测定空气中氧气的含量,若整个实验过程中忘记夹弹簧夹, 则最终液面上升的高度约 ____瓶内空气体积的 ![]() 。(填“大于”或“小于”)
。(填“大于”或“小于”)
【答案】木条复燃;质量仍为0.2g;木条复燃;①与③证明CuO在反应前后化学性质是否改变红磷+氧气![]() 五氧化二磷气密性良好 ;先向右移动后向左移动;8ml大于
五氧化二磷气密性良好 ;先向右移动后向左移动;8ml大于
【解析】
催化剂在反应过程中,改变的是化学反应速率,其质量和化学性质不变。密闭容器中气体减少,压强变小。
探究一:(1)CuO是过氧化氢分解反应的催化剂,加快了过氧化氢分解反应的速率,步骤③中产生了大量的氧气,能使带火星的木条复燃。催化剂在化学反应前后质量不变。催化剂在化学反应前化学性质不变,仍然能作过氧化氢分解反应的催化剂,所以步骤⑦的现象是溶液中有气泡放出,木条复燃。(2)①中带火星的木条没有复燃,③中带火星的木条复燃了,说明加入CuO后,产生了大量的氧气,即CuO加快了过氧化氢的分解速率。(3)将过滤出的CuO加入过氧化氢溶液中,如果把带火星的木条伸入试管中,带火星的木条复燃了,说明过滤出的CuO仍能加快过氧化氢的分解速率,所以步骤⑦的目的是证明CuO在反应前后化学性质是否改变。探究二:(1)红磷燃烧生成五氧化二磷。(2)①实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明装置气密性良好。②红磷燃烧放出大量的热,使试管内的气体体积变大,活塞向右移动。降温过程中,试管中的气体体积逐渐变小,所以活塞逐渐向左移动,由于红磷燃烧消耗了氧气,试管中气体减少,减少的气体是消耗的氧气的体积,试管与注射器的总体积是40ml+20ml=60ml,其中氧气的体积约是60ml×![]() =12ml,所以装置中减少的气体体积是12ml,由于装置中的压强变小,所以活塞向左移动,最终停在20ml-12ml=8ml刻度处。(3)如果实验过程中没有夹弹簧夹,红磷燃烧放出大量的热,使气体体积变大而从瓶中逸出,当反应停止,冷却到室温后,进入水的体积偏多,所以最终液面上升的高度约大于瓶内空气体积的
=12ml,所以装置中减少的气体体积是12ml,由于装置中的压强变小,所以活塞向左移动,最终停在20ml-12ml=8ml刻度处。(3)如果实验过程中没有夹弹簧夹,红磷燃烧放出大量的热,使气体体积变大而从瓶中逸出,当反应停止,冷却到室温后,进入水的体积偏多,所以最终液面上升的高度约大于瓶内空气体积的![]() 。
。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案