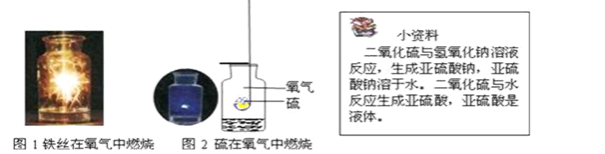
题目内容
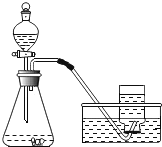
【题目】I某兴趣小组利用下列装置进行实验室制取和收集气体的实验,请回答:
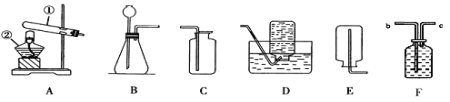
(1)指出仪器名称:①_______________。
(2)实验室能用排水法收集氧气,是因为_____________;若用F装置收集氧气,则气体从______端进(填“b”或“c”) 。实验室也能用___________收集氧气,用此气法收集氧气,验满的方法是________________________。
(3)已知实验室没有棉花了,请写出用A装置制取氧气的文字表达式________________。
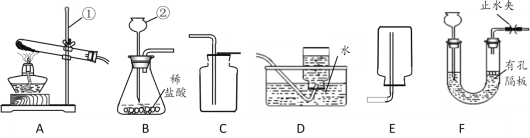
(4)已知:氨气(NH3)是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水,实验室常用加热氯化铵和熟石灰两种固体的混合物来制备氨。请你从如图中选出制备一瓶氨气所需要的装置组合是______________。
II已知常温下,A是暗紫色固体,B是黑色固体,F是黄色固体,D和H是气体,E和G是无色液体,H是一种有害气体,实验室可用G来吸收少量的H,请根据下图回答问题;
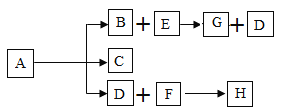
(1)A________B________D________E________F________(填符号)
(2)F在氧气中点燃的现象是____________________________
(3)请写出由E ![]() G的符号表达式__________________
G的符号表达式__________________
(4)请写出由A ![]() C的文字表达式________,该反应类型是___________ (填“化合”或“分解”)
C的文字表达式________,该反应类型是___________ (填“化合”或“分解”)
【答案】试管氧气不易溶于水且不与水反应C向上排空气法将带火星的木条放在集气瓶口,若木条复燃则说明收集满了氯酸钾 ![]() 氯化钾+氧气AEKMnO4MnO2O2H2O2S发出明亮的蓝紫色火焰,放出热量,生成有刺激性性气味的气体H2O2
氯化钾+氧气AEKMnO4MnO2O2H2O2S发出明亮的蓝紫色火焰,放出热量,生成有刺激性性气味的气体H2O2![]() H2O+O2高锰酸钾
H2O+O2高锰酸钾![]() 锰酸钾+二氧化锰+氧气分解
锰酸钾+二氧化锰+氧气分解
【解析】
I.根据氧气的收集方法,验满方法,氯酸钾制氧气的原理,制取气体发生装置和收集装置选择方法进行分析解答;
II .根据“A是暗紫色固体”,可得到A高锰酸钾,利用高锰酸钾分解的产物和物质间的变化关系,得到B和D分别是二氧化锰和氧气;根据“F是黄色固体、H是一种有害气体”和物质间的变化关系,得到F是硫,H是二氧化硫;根据B和E生成G和D,E和G是无色液体,B是二氧化锰,可得到E是过氧化氢,G是水。最后将结果代入框图进行验证。
I.
(1)仪器名称①试管;
(2)实验室能用排水法收集氧气,是因为氧气不易溶于水且不与水反应;氧气不易溶于水,密度比水小,若用F装置收集氧气,则气体从c端进;氧气的密度大于空气,实验室也能用向上排空气法收集氧气,氧气具有助燃性,用此气法收集氧气,验满的方法是将带火星的木条放在集气瓶口,若木条复燃则说明收集满了;
(3)A装置制取氧气,反应物是固体,反应条件是加热,实验室没有棉花,可用氯酸钾与二氧化锰加热制氧气,氯酸钾与二氧化锰共热分解生成氯化钾和氧气,反应的文字表达式是氯酸钾 ![]() 氯化钾+氧气;
氯化钾+氧气;
(4)加热氯化铵和熟石灰两种固体的混合物来制备氨气,属于固体加热型,应该选用的发生装置是A;氨气密度比空气小,极易溶于水,可选用向下排空气法收集,即收集装置为E,从如图中选出制备一瓶氨气所需要的装置组合是AE;
II.
A是暗紫色固体,则A高锰酸钾,A能生成B、C、D,高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,其中二氧化锰是黑色固体,B是二氧化锰,D是气体,则D是氧气; F是黄色固体且能与氧气反应生成H,H是一种有害气体,硫与氧气反应生成二氧化硫,二氧化硫在空气中易形成酸雨,是一种有害气体,F可能是硫, H是二氧化硫;E和G是无色液体,二氧化锰能与E反应生成G和氧气,过氧化氢与二氧化锰混合生成水和氧气,E是过氧化氢,G是水,实验室可用水来吸收少量的二氧化硫。因此:
(1)A是高锰酸钾,化学式是KMnO4;B是二氧化锰,化学式是MnO2;D氧气,化学式是O2;E是过氧化氢,化学式是H2O2;F是硫,化学式是S;
(2)硫在氧气中点燃的现象是发出明亮的蓝紫色火焰,放出热量,生成有刺激性性气味的气体;
(3)E![]() G的反应是过氧化氢与二氧化锰混合生成水和氧气,符号表达式是H2O2
G的反应是过氧化氢与二氧化锰混合生成水和氧气,符号表达式是H2O2![]() H2O+O2;
H2O+O2;
(4)由A ![]() C的反应是高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,文字表达式高锰酸钾
C的反应是高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,文字表达式高锰酸钾![]() 锰酸钾+二氧化锰+氧气,该反应是由一种生成三种物质,属于分解反应。
锰酸钾+二氧化锰+氧气,该反应是由一种生成三种物质,属于分解反应。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】某校化学兴趣小组的同学在老师的指导下做了有关氧气系列探究实验:
探究一:学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:CuO(氧化铜)能否起到类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想)Ⅰ.CuO不是过氧化氢分解反应的催化剂 Ⅱ.CuO是过氧化氢分解反应的催化剂。
(实验)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
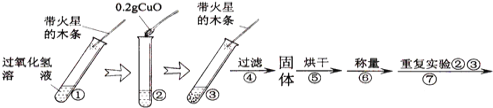
(1)
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
__________ | __________ | 溶液中有气泡放出,______ | 猜想Ⅰ不成立; 猜想Ⅱ成立. |
(2)能证明CuO加快了过氧化氢分解速率的实验步骤是_________________。
(3)步骤⑦的目的是________________________。
探究二:对空气中氧气含量的测定实验进行探究:
某化学兴趣小组对教材中“测定空气里氧气含量”的实验(见图Ⅰ)进行了大胆改进,设计(如图 Ⅱ)(选用容积为40mL试管作反应容器)实验方案进行,收到了良好的效果。请你对比分 析下面图Ⅰ、图Ⅱ实验,回答下列有关问题:
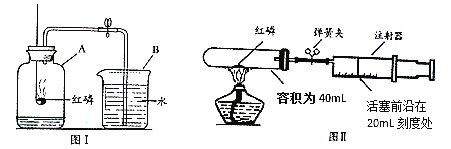
(1)图Ⅰ实验中:红磷在空气中燃烧(如图);该反应的文字表达式___;
(2)图Ⅱ实验中:
①实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明___________________;
②图Ⅱ实验,若打开弹簧夹,用酒精灯加热红磷,从红磷燃烧到熄灭冷却的实验过程中,注射器活塞将___________________移动,最终约停止在____mL刻度处。
(3)反思:小林同学利用图Ⅰ装置测定空气中氧气的含量,若整个实验过程中忘记夹弹簧夹, 则最终液面上升的高度约 ____瓶内空气体积的 ![]() 。(填“大于”或“小于”)
。(填“大于”或“小于”)