题目内容
【题目】铝及化合物有极其重要的用途。
(一)铝的广泛应用
(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是________________________。使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指_____________。
A. 单质 B. 元素 C. 原子 D. 分子
(2)铝的化学性质比较活泼,还能与氢氧化钠溶液反应生成偏铝酸钠(化学式为NaAlO2)和一种可燃性气体,写出该反应的化学方程式________________________。
(二)硫酸铝铵晶体制取的探究
硫酸铝铵是一种用途广泛的含铝化合物。以某铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3杂质)为原料制硫酸铝铵晶体((NH4)aAlb(SO4)c·xH2O)的流程如下:
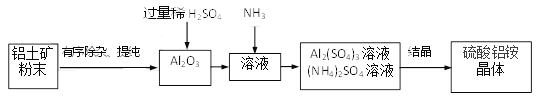
(3)有关上述流程的说法正确的是______。
a.“有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2
b. 稀硫酸过量的目的只是保证Al2O3溶解完全
(三)硫酸铝铵晶体分解的定性探究
硫酸铝铵热分解可得到纳米氧化铝。兴趣小组设计实验探究硫酸铝铵晶体受热分解的产物。
(4)甲组同学设计了如图1所示实验装置:
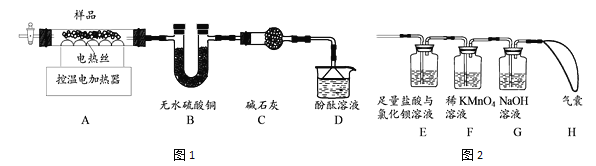
① 实验中,装置B中观察到的现象是_________________。
② 装置D中观察到酚酞溶液变红色,由此可知分解的产物中有______(写化学式)。
(5)乙组同学认为硫酸铝铵晶体受热分解的产物中还有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和上图2所示装置连接进行实验。观察到装置E中______,证明了有SO3生成;而F装置中_____________、H最终没有胀大,表明没有SO2和N2生成。
(四)硫酸铝铵晶体成分的定量探究
(6)为确定硫酸铝铵晶体的组成,进行如下实验:
(实验1)称取45.3g样品与足量氯化钡溶液充分反应,生成白色沉淀46.6g。
(实验2)称取45.3g样品在空气中持续加热,测定剩余固体质量随温度变化的曲线如图所示。
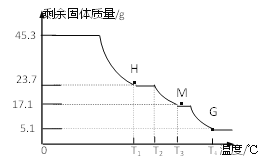
①固体H是T1℃刚好完全失去结晶水的产物,则结晶水的个数x=_____________。
②T3℃时固体M的化学式_____________。
③请写出T2℃→T4℃段发生反应的总化学方程式:________________________。
【答案】 表面形成致密而结实的氧化膜 B 2NaOH + 2Al + 2H2O == 2NaAlO2 + 3H2↑ a 变蓝色 NH3 产生白色沉淀 不褪色或无现象 12 Al2(SO4)3 2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
【解析】(一) (1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是常温下,铝和空气中的氧气缓慢反应生成致密的氧化铝保护膜,阻止铝的进一步锈蚀;使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指元素; (2)据质量守恒定律可知反应前后元素的种类不变,铝与氢氧化钠溶液反应生成偏铝酸钠(化学式为NaAlO2)和可燃性气体(氢气),该反应的化学方程式2NaOH + 2Al + 2H2O == 2NaAlO2 + 3H2↑;(二)(3) a.二氧化硅和盐酸不反应。“有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2,正确b. 稀硫酸过量的目的是保证Al2O3、氧化铁都溶解完全,错误;(三) (4) ① 硫酸铜和水结合生成蓝色的硫酸铜晶体,实验中,装置B中观察到的现象是白色固体变蓝,证明有水生成;②氨气溶于水产生氨水,显碱性,能使无色酚酞试液变红, 装置D中观察到酚酞溶液变红色,由此可知分解的产物中有氨气:NH3;(5)三氧化硫和水反应生成硫酸,硫酸和氯化钡反应生成不溶于酸的硫酸钡沉淀。观察到装置E中产生白色沉淀,证明了有SO3生成;二氧化硫有还原性,能使高锰酸钾褪色,而F装置中高锰酸钾溶液没有褪色,H最终没有胀大,表明没有SO2和N2生成;(四)【实验2】化学式中原子(或原子团)的个数比为最简整数比。①固体H是T1℃刚好完全失去结晶水的产物,(45.3-23.7)÷18=1.2,则结晶水的个数x=12;②硫酸铝的相对分子质量是342,由T3℃时固体M的质量是17.1g,可推知M为硫酸铝,化学式为Al2(SO4)3;③ 由题中信息可知,T2℃时,硫酸铝铵晶体失去结晶水,成为硫酸铝铵,硫酸铝铵分解的最终产物是氧化铝、氨气、三氧化硫、水,T2℃→T4℃段发生反应的总化学方程式:2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑+ H2O ↑ + 2NH3 ↑ 。
Al2O3 + 4SO3 ↑+ H2O ↑ + 2NH3 ↑ 。

【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到_________________,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
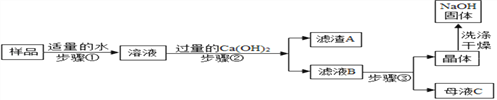
[实验分析]:
⑴步骤②反应的化学方程式是____________,步骤②的操作有搅拌和过滤,搅拌的作用是_______.
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是_________.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、_________、过滤. A.蒸发结晶B.降温结晶
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是_______________.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
⑸表中第_________次恰好完全反应.
⑹请计算样品中氢氧化钠的质量分数为_____________?(请写具体解题过程)
【题目】下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH 6.5~8.5,铜<1.0mgL-1,氟化物<1.0mgL-1,游离氯≥0.3mgL-1等 |
⑴感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的 pH=8时,表明自来水呈________ (填“酸性”、“碱性”或“中性”)。
⑵天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
⑶硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
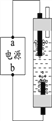
⑷液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
⑸饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_________。
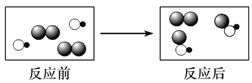
⑹ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
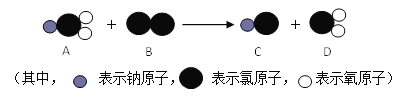
该反应的化学方程式是_________________。