题目内容
【题目】下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH 6.5~8.5,铜<1.0mgL-1,氟化物<1.0mgL-1,游离氯≥0.3mgL-1等 |
⑴感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的 pH=8时,表明自来水呈________ (填“酸性”、“碱性”或“中性”)。
⑵天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
⑶硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
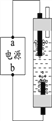
⑷液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
⑸饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_________。
⑹ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
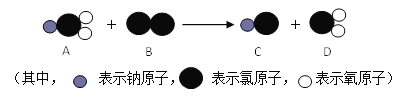
该反应的化学方程式是_________________。
【答案】 物理 碱性 蒸馏 肥皂水 煮沸 2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl 2↑ 电能 0 71:4 2NaClO2 + Cl2 =2ClO2 + 2NaCl
2NaOH + H2↑+ Cl 2↑ 电能 0 71:4 2NaClO2 + Cl2 =2ClO2 + 2NaCl
【解析】本题较全面地考查了水的净化的知识,涉及的知识面较广,全面地掌握有关的基础知识是解题的关键。
(1)感官指标表现的自来水的性质,不需要经过化学变化来表现,是物理性质,在化学指标中的pH=8时大于7,表明自来水呈碱性;
(2)在吸附、沉淀、过滤和蒸馏等方法净化水时,只有蒸馏得到的水是纯水,净化程度最高的方法是蒸馏;
(3)生活中可用肥皂水来区分硬水和软水,硬水遇肥皂水产生的泡沫少,遇软水产生的泡沫多,常用煮沸的方法来降低水的硬度;
⑷氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为2NaCl + 2H2O ![]() 2NaOH + H2↑+ Cl 2↑;从能量变化角度看,该反应中将电能转化为化学能。
2NaOH + H2↑+ Cl 2↑;从能量变化角度看,该反应中将电能转化为化学能。
(5)O3是一种单质,氧元素的化合价是0,在NH2Cl中氯元素与氢元素的质量比是:35.5:(2×1)=71:4;
(6)根据反应中各物质分子的微观模型图,各物质的化学式分别为NaClO2、Cl2、NaCl、ClO2,则反应的化学方程式为2NaClO2+Cl2=2NaCl+2ClO2。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案