题目内容
【题目】同学们在实验室将5%的NaOH溶液逐滴加入到14g稀盐酸中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请回答:
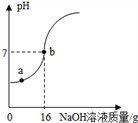
(1)a点溶液中含有的阳离子有_________。
(2)当pH=7时,消耗NaOH的质量为__________g。
(3)求恰好完全反应时所得溶液中溶质质量分数_________(写出计算过程,最后结果精确到0.1%)。
【答案】 Na+ 、H+ 0.8g 3.9%
【解析】(1)a点时氢氧化钠与氯化氢恰好反应生成氯化钠,则该溶液中大量存在的离子为:Na+、H+;
(2)根据图示可知,两溶液恰好完全反应时消耗NaOH溶液的质量为16g,氢氧化钠的质量为16g×5%=0.8g;
(3)解:设恰好完全反应时溶液中溶质的质量为x,
NaOH+HCl═NaCl+H2O,
40 58.5
16g×5%x
![]()
解得:x=1.17g,
恰好完全反应时溶液中溶质的质量分数: ![]() ×100%=3.9%,
×100%=3.9%,
答:恰好完全反应时溶液中溶质的质量分数为3.9%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目