题目内容
【题目】取一定量的过氧化氢溶液于试管中,加入少量二氧化锰,充分反应后,下列图象表示的反应过程与事实一致的是
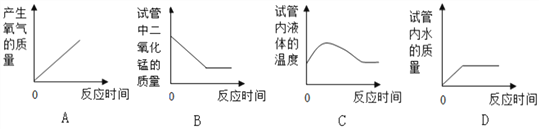
A. A B. B C. C D. D
【答案】C
【解析】A、室温下,过氧化氢溶液和二氧化锰一接触马上产生氧气,所以产生氧气的时间是从零开始的,直到过氧化氢溶液中的过氧化氢完全分解,即不在产生氧气,所以产生氧气的质量随着时间的变化应该是从零点出发,至完全反应后气体的质量不在变化,此时曲线应该是和时间轴平行的,错误;B、过氧化氢溶液中加入少量二氧化锰后立即产生氧气,二氧化锰是催化剂,反应前后质量不变,错误;C、由于反应会放出大量的热,所以随着反应溶液的温度会增高,而后向空气中散失热量,温度降低,正确;D、过氧化氢溶液中加入少量二氧化锰后立即产生氧气,同时生成水,水的质量增加,但不会从0开始,错误。故选C。

 王后雄学案教材完全解读系列答案
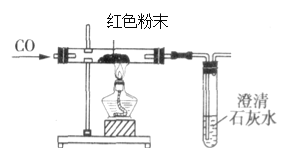
王后雄学案教材完全解读系列答案【题目】一包干燥的红色粉末,由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成。下面是同学们的探究过程,请你参与并回答有关问题。
【提出问题】
猜想①:只有Cu 猜想②:只有Fe2O3
猜想③:只有Fe(OH)3 猜想④:是Fe(OH)3和Fe2O3的混合物
猜想⑤:是Cu、Fe2O3的混合物 猜想⑥是____的混合物
【查阅资料】
(1)2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
(2)Cu溶解在Fecl3溶液中,得到FeCl2和CuCl2
[实验探究]
(3)甲同学进行下列实验,请你填写表中空白处。
实验操作步骤 | 实验现象 | 结论 |
①取用少量红色固体,放于试管中加热 | 固体没有明显变化,试管口附近内壁没有发现小液滴 | 红色固体不含________ |
②取少量红色粉末于试管中,滴加足量的稀盐酸 | 发现固体全部溶解,溶液变色 | 猜想_____可能成立,所可能涉及的化学反应方程式是___ |
(4)在甲同学实验的基础上,乙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按右图装置进行实验。实验时发现澄清石灰水变浑浊,证明红色粉末中含有Fe2O3硬质玻璃管中发生反应的化学方程式是______反应完全后测得石灰水质量增加6.6g(假定CO足够多,石灰水足量,产生气体全部被吸收)则请计算出该红色粉末中各成分的质量____
【反思评价】丙同学指出:从环保角度,乙同学的实验装置有严重不足之处。请提出你的具体改进措施及原因:________________