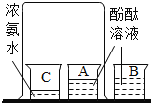
题目内容
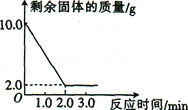
【题目】某兴趣小组为测定某赤铁矿中氧化铁的含量,取10 g赤铁矿(主要成分为Fe2O3,假设其中的杂质不溶于水,也不与稀硫酸反应)置于烧杯中,加入足量的稀硫酸,烧杯中剩余固体的质量随反应时间的变化曲线如图所示。
请计算:(1)Fe2O3中铁元素的质量分数为_______ 。
(2)反应中消耗H2SO4的质量_________。
【答案】 70% 14.7g
【解析】解:(1)Fe2O3中铁元素的质量分数为:![]() ×100%=70%。
×100%=70%。
(2)由曲线图可知铁矿石中Fe2O3的质量为10g-2.0g=8.0g,
设反应中消耗H2SO4的质量为x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
8.0g x
![]()
解得:x=14.7g
答:(1)Fe2O3中铁元素的质量分数为70%;
(2)反应中消耗H2SO4的质量为14.7g。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目