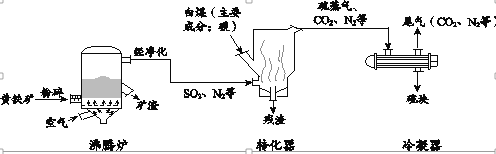
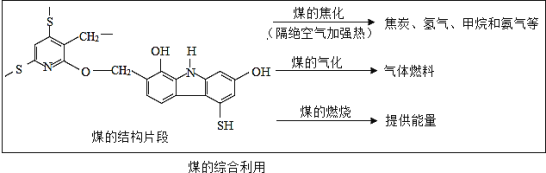
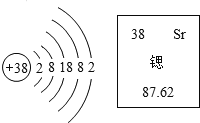
题目内容
【题目】学习《海水“制碱”》的知识后,小明在实验室中进行了如下探究活动,请你和小明一起完成下面的实验探究活动。
(1)探究碳酸钠的溶解性:在编号为 A、B、C、D 的四个烧杯中各加入室温下的水 100g,并分别加入取自实验室的碳酸钠固体,搅拌至充分溶解,实验数据记录如下表:
烧杯编号 | A | B | C | D |
水的质量/g | 100 | 100 | 100 | 100 |
加入 Na2CO3 的质量/g | 30 | 35 | 40 | 50 |
溶液的质量/g | 130 | 135 | 140 | 140 |
分析上述数据,烧杯编号为_________中的溶液是饱和溶液。
(2)探究食用纯碱的纯度:小明把家中厨房里的食用纯碱(主要成分是Na2CO3)带到实验室,他称取食用纯碱12.0g放入烧杯中,加入200g水使其完全溶解。现将150g一定浓度的CaCl2溶液逐滴滴入烧杯中,测得滴加氯化钙溶液的质量与生成沉淀的质量关系如下表:
CaCl2 溶液的质量/g | 25 | 50 | 75 | 100 | 125 | 150 |
沉淀的质量/g | 2 | 4 | m | 8 | 10 | 10 |
①m 的数值是 ______。
②计算纯碱样品中碳酸钠的质量分数______(写出计算过程,计算结果保留一位小数)。
③滴加氯化钙溶液过量的目的是______。
【答案】CD 6 88.3% 将碳酸钠完全反应
【解析】
(1)A、B、C三个烧杯中溶液的质量等于水的质量+加入的Na2CO3 的质量,说明A、B烧杯中溶液肯定为不饱和溶液,C可能为饱和溶液,又由于D中水的质量+加入的Na2CO3 的质量为150g,溶液质量为140g,等于C的质量,所以D为饱和溶液,C也为饱和溶液;
(2)①由表中信息可知,滴加氯化钙质量25g至125g之间,每增加25g,沉淀质量增加2g,所以m的值为6;
②由表中信息可知,产生沉淀的质量为10g,
设参加反应的碳酸钠的质量为x,
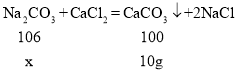
![]()
x=10.6g
纯碱样品中碳酸钠的质量分数![]()
③滴加氯化钙溶液过量的目的是将碳酸钠完全反应。