题目内容
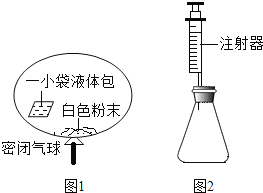
【题目】某研究小组对自动充气气球(如下图1所示)进行下列探究。
(查阅资料)该气球充气原理是通过挤破气球内液体包使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
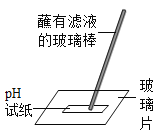
(1)为检验气体是二氧化碳,可选用________(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液pH=3,则该溶液呈酸性。
探究二:白色粉末成分的探究
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠
(设计并进行实验)
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想_______(填“正确”或“不正确”))。
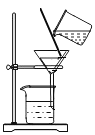
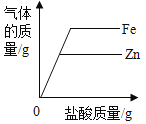
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸(装置如上图2所示),记录如下表。
实验编号 | 锥形瓶内物质 | 最终得到CO2的体积/mL | |
物质 | 质量/g | ||
① | 碳酸氢钠 | 0.10 | V1 |
② | 碳酸钠 | 0.10 | V2 |
③ | 白色粉末 | X | V1 |
实验②的化学方程式为___________;表中X =______g;V1________(填“>”“<”或“=”) V2
(5)分析上表实验数据得出的结论及判断依据是_________。
【答案】澄清石灰水(或氢氧化钙溶液) 不正确 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 0.10 > 白色粉末是碳酸氢钠,因为0.1g的该白色粉末所得二氧化碳与等质量的碳酸氢钠所得二氧化碳体积相等
【解析】
(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以为检验气体是二氧化碳,可选用氢氧化钙溶液;故填:澄清石灰水(或氢氧化钙溶液);
(3)碳酸钙难溶于水,所以将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确;故填:不正确;
(4)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,碳酸氢钠、碳酸钠的质量都是0.1g,为了形成对比,所以x的质量也是0.1g,每84份质量的碳酸氢钠会生成44份质量的二氧化碳,每106份质量的碳酸钠会生成44份质量的二氧化碳,所以V1>V2;故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;0.10;>;
(5)因为0.1g的该白色粉末所得二氧化碳与等质量的碳酸氢钠所得二氧化碳体积相等,所以该白色粉末是碳酸氢钠。故填:白色粉末是碳酸氢钠,因为0.1g的该白色粉末所得二氧化碳与等质量的碳酸氢钠所得二氧化碳体积相等。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案