题目内容
【题目】为确定某固体洗涤助剂成分,兴趣小组进行如下探究:
(查阅资料)
(1)双氧水常用于漂白、消毒、杀菌,但不易保存。洗涤助剂具有相同作用,且易于保存。
(2)制取方法为:将一定量的质量分数为 30%的 H2O2 溶液和 Na2SO4 混合溶解,加入 NaCl,有白色固体析出,过滤得助剂。
(资料分析)由资料(1)可知助剂中一定含______。
(提出猜想)
(1)助剂中含 Na2SO4 和H2O2;(2)助剂中含NaCl 和H2O2;(3)助剂中含_____。
(实验探究)
步骤 1:将少量助剂溶解,向溶液中加入某种黑色粉末,有气泡产生。
步骤 2:另取少量助剂溶解,加热至不再产生气泡;向溶液中加入足量 BaCl2溶液,产生白色沉淀;过滤。
步骤 3:向步骤 2 所得滤液中加入足量AgNO3 溶液,有白色沉淀生成。
(1)步骤 1 反应的化学方程式为______。可用______检验产生的气体。
(2)步骤 2 中将助剂溶液充分加热的目的是______;由该实验可知助剂中存在______。
(3)步骤 3 中白色沉淀为______。
(4)甲同学由步骤 3 得出结论:助剂中含有NaCl;乙同学认为不能得出此结论,理由是_________。
(5)丙同学提出可通过如下方案确定助剂中是否含有 NaCl:将少量助剂溶解,加热至不再有气泡产生。向溶液中加入足量的试剂 X,产生沉淀。过滤,向所得滤液中滴加 AgNO3 溶液。若有白色沉淀,则含有 NaCl。其中试剂X 为______(填对应选项的字母)。
A CaCl2 B Na2CO3 C Ba(NO3)2
(实验结论)猜想 3 正确。
【答案】H2O2 Na2SO4 、H2O2、NaCl 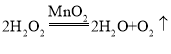 带火星的木条 使过氧化氢充分反应 Na2SO4 AgCl 氯化钡与硫酸钠反应生成的氯化钠和过量的氯化钡都能与硝酸银反应生成氯化银白色沉淀 C
带火星的木条 使过氧化氢充分反应 Na2SO4 AgCl 氯化钡与硫酸钠反应生成的氯化钠和过量的氯化钡都能与硝酸银反应生成氯化银白色沉淀 C
【解析】
资料由资料(1)可知助剂中一定含:H2O2;
提出猜想:结合猜想(1)和猜想(2),(3)助剂中含:Na2SO4 、H2O2、NaCl;
实验探究:
(1)将少量助剂溶解,向溶液中加入某种黑色粉末,有气泡产生,黑色粉末可能是二氧化锰,过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为: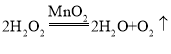 ,可用带火星的木条检验生成的氧气,带火星的木条复燃,说明是氧气;
,可用带火星的木条检验生成的氧气,带火星的木条复燃,说明是氧气;
(2)步骤 2 中将助剂溶液充分加热的目的是:使过氧化氢充分反应;
向溶液中加入足量 BaCl2溶液,产生白色沉淀,氯化钡能与硫酸钠反应生成硫酸钡白色沉淀和氯化钠,故该实验可知助剂中存在:Na2SO4;
(3)向步骤 2 所得滤液中加入足量AgNO3 溶液,有白色沉淀生成,银离子能与氯离子结合成氯化银白色沉淀,故白色沉淀为:AgCl;
(4)氯化钡与硫酸钠反应生成的氯化钠和过量的氯化钡都能与硝酸银反应生成氯化银白色沉淀,不能证明助剂中含有NaCl;
(5)为确定助剂中是否含有 NaCl,可取少量助剂溶解,加热至不再有气泡产生。向溶液中加入足量的试剂X,试剂X既要能与硫酸钠反应生成沉淀,除去硫酸钠,又不能引入氯离子,故X可以是硝酸钡,硝酸钡能与硫酸钠反应生成硫酸钡和硝酸钠,过滤,除去硫酸钠,然后向所得滤液中滴加 AgNO3溶液,硝酸银能与氯化钠反应生成氯化银和硝酸钠,若有白色沉淀,则含有 NaCl。故选C。

 通城学典默写能手系列答案
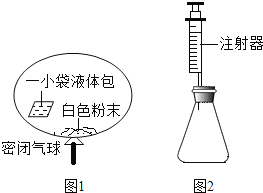
通城学典默写能手系列答案【题目】某研究小组对自动充气气球(如下图1所示)进行下列探究。
(查阅资料)该气球充气原理是通过挤破气球内液体包使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)为检验气体是二氧化碳,可选用________(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液pH=3,则该溶液呈酸性。
探究二:白色粉末成分的探究
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠
(设计并进行实验)
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想_______(填“正确”或“不正确”))。
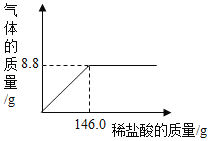
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸(装置如上图2所示),记录如下表。
实验编号 | 锥形瓶内物质 | 最终得到CO2的体积/mL | |
物质 | 质量/g | ||
① | 碳酸氢钠 | 0.10 | V1 |
② | 碳酸钠 | 0.10 | V2 |
③ | 白色粉末 | X | V1 |
实验②的化学方程式为___________;表中X =______g;V1________(填“>”“<”或“=”) V2
(5)分析上表实验数据得出的结论及判断依据是_________。
【题目】在老师的指导下,小乐同学探究金属和盐溶液反应时,发现将钠放入MgCl2溶液中有气泡和白色沉淀产生。为了进一步探究,小乐同学将充分反应后的混合物过滤,得固体A和滤液B。
(查阅资料)①钠与水反应生成氢氧化钠和氢气。②2NaOH+ MgCl2= 2NaCl +Mg(OH)2↓。③MgCl2溶液呈酸性。
(分析思考)
小乐同学根据所学知识对产生的气体和固体A进行判断:
(1)产生的气体是____(填序号)。①CO2 ②H2 ③Cl2
(2)取A加入过量稀盐酸中,A全部溶解,无气泡产生,则A的名称是____。
(提出问题)滤液B中溶质的成分是什么?
猜想一:NaCl 猜想二:NaCl、MgCl2
猜想三:NaCl、NaOH 猜想四:NaCl、MgCl2、NaOH
小乐同学认为猜想____不成立,理由是____。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
步骤一:取少量滤液B于试管中,滴加几滴无色酚酞,振荡,观察现象 | 溶液__ | 猜想三不成立 |
步骤二:取少量滤液B于试管中,滴加适量 NaOH溶液,振荡,观察现象 | 产生白色沉淀 | 猜想_____成立 |
(实验结论)在金属活动性顺序里,钠不能将位于它后面的金属从该金属的盐溶液中置换出来。
(拓展延伸)将钠与MgCl2固体隔绝空气加热到一定温度时,钠可以从氯化镁中置换出镁,该反应的化学方程式是____。