题目内容
【题目】菱镁矿中主要含MgCO3、FeCO3和SiO2。以菱镁矿为原料制取镁的工艺流程如下。
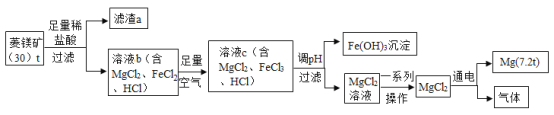
回答下列问题:
(1)菱镁矿属于___(选填“纯净物”或“混合物”)。
(2)流程中滤渣a主要成分是___。
(3)写出菱镁矿中MgCO3与稀HC1反应的化学方程式___。
(4)溶液b→溶液c反应的化学方程式为:![]() (补充完方程式)____。
(补充完方程式)____。
(5)溶液c调pH使Fe2+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8-__。
已知:物质沉淀的pH见下表:
物质 | Mg(OH)2 | Fe(OH)3 |
开始沉淀的pH | 8.9 | 1.5 |
完全沉淀的pH | 10.9 | 2.8 |
(6)结合流程中的数据计算。
①菱铁矿中镁元素的质量分数为_____(不考虑整个流程转化中的损失)。
②MgCl2通电制得的气体的质量____(写出计算过程)。
【答案】混合物 SiO2 ![]()
![]() 8.9 24% 21.3t
8.9 24% 21.3t
【解析】
(1)菱镁矿中主要含MgCO3、FeCO3和SiO2,所以菱镁矿属于混合物;
(2)菱镁矿中主要含MgCO3、FeCO3都能与盐酸反应,而SiO2与稀盐酸不反应,所以流程中滤渣a主要成分是SiO2;
(3)菱镁矿中MgCO3与稀HCl反应生成氯化镁、二氧化碳和水,反应的化学方程式为:![]() ;
;
(4)由质量守恒定律可知,化学反应前后原子的种类与数目保持不变,反应前有:4个铁原子、12个氯原子和4个氢原子;反应后有:4个铁原子、12个氯原子、4个氢原子和2个氧原子,所以空格处应填写![]() ;
;
(5)由表格中的数据可知,溶液c调pH使Fe3+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8~8.9;
(6)①菱铁矿中镁元素的质量分数为![]() ;
;
②设制得气体的质量为x,则:
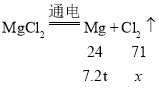
![]()
x=21.3t;
答:MgCl2通电制得的气体的质量为21.3t。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案