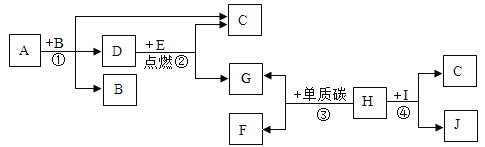
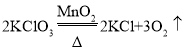题目内容
【题目】董加亦轩同学配制50 g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
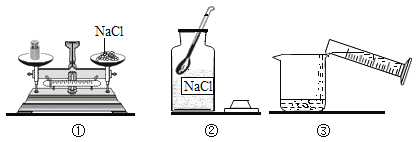
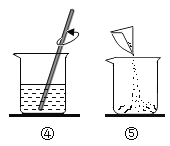
(1)配制溶液的正确操作顺序为_____ (填序号, 下同),其中操作错误的是_____。
(2)图②中盛放氯化钠固体的仪器名称是_____ , 需称取氯化钠_____g。
(3)④中玻璃棒的作用是_____。
(4)量取水时选用的量筒的量程最合适的是_____ (填序号), 读数时视线要与量筒内_____保持水平。
A 10mL
B 25 mL
C 50 mL
D 100 mL
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____ (填序号) 。
A 氯化钠固体不纯
B 用生锈砝码称量
C 装瓶时有少量溶液洒出
D 溶解时烧杯内壁有水珠
(6)预防冠状病毒,除戴口罩外,必要的消毒是必不可少的。中国著名传染病学专家李兰娟院士表示,新型冠状病毒对热敏感,75%的乙醇,含氯的消毒剂都可以有效地灭活病毒。请你根据所学知识配制校园消毒剂,为即将到来的线下开学做好准备。现有500mL96%乙醇溶液,若要配制成75%乙醇溶液,需要加水_____g。 (已知: 96%的乙醇溶液密度为0.79 g/mL)
【答案】②①⑤③④ ① 广口瓶 3.0 搅拌,加速溶解 C 凹液面的最低处 AD 110.6
【解析】
配制50g 6%的氯化钠溶液,则有:
(1)配制溶液的步骤为计算、称量、溶解、装瓶等,如图所示的操作中正确操作顺序为②①⑤③④,其中操作错误的是①,托盘天平使用时,砝码放在右盘,物品放在左盘,图中的物品与砝码的位置放反了。
(2)图②中盛放氯化钠固体的仪器名称是广口瓶,需称取氯化钠![]() 。
。
(3)④溶解的步骤中中玻璃棒的作用是搅拌,加速溶解。
(4)需称取氯化钠3.0g,需要水的质量为50g-3.0g=47.0g,即量取水47mL,选择的量筒的量程要接近于47mL,则选用的量筒的量程最合适的是50 mL,C选项正确,符合题意,故选C;读数时视线要与量筒内凹液面的最低处保持水平。
(5)A、氯化钠固体不纯,溶液中溶质的质量偏小,所得溶液的溶质质量分数偏小,A选项正确,符合题意;
B、用生锈得砝码称重,会造成称取的氯化钠的质量偏大,所得溶液的溶质质量分数偏大,B选项不正确,不符合题意;
C、装瓶时溶液有部分洒出,对所得溶液的溶质质量分数无影响,C选项不正确,不符合题意;
D、溶解时烧杯内壁有少量的水珠,会造成所加水的质量偏大,使所得溶液溶质的质量分数偏小,D选项正确,符合题意。故选AD。
(6)已知96%的乙醇溶液密度为0.79 g/mL,则500mL96%乙醇溶液的质量为![]() ,若要配制成75%乙醇溶液,设需要加水的质量为x,则有
,若要配制成75%乙醇溶液,设需要加水的质量为x,则有![]() ,解得x=110.6g。故需要加水的质量为110.6g。
,解得x=110.6g。故需要加水的质量为110.6g。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】菱镁矿中主要含MgCO3、FeCO3和SiO2。以菱镁矿为原料制取镁的工艺流程如下。
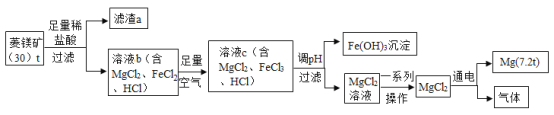
回答下列问题:
(1)菱镁矿属于___(选填“纯净物”或“混合物”)。
(2)流程中滤渣a主要成分是___。
(3)写出菱镁矿中MgCO3与稀HC1反应的化学方程式___。
(4)溶液b→溶液c反应的化学方程式为:![]() (补充完方程式)____。
(补充完方程式)____。
(5)溶液c调pH使Fe2+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8-__。
已知:物质沉淀的pH见下表:
物质 | Mg(OH)2 | Fe(OH)3 |
开始沉淀的pH | 8.9 | 1.5 |
完全沉淀的pH | 10.9 | 2.8 |
(6)结合流程中的数据计算。
①菱铁矿中镁元素的质量分数为_____(不考虑整个流程转化中的损失)。
②MgCl2通电制得的气体的质量____(写出计算过程)。