题目内容
【题目】下列图象不能正确反映对应变化关系的是( )
A. 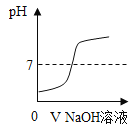 表示向pH=2的盐酸中不断加入NaOH溶液
表示向pH=2的盐酸中不断加入NaOH溶液
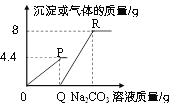
B. 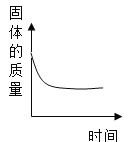 表示一定量的Fe加到AgNO3溶液中
表示一定量的Fe加到AgNO3溶液中
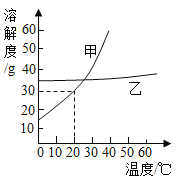
C. 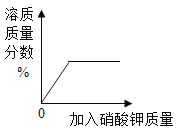 表示在20℃时,向一定量的水中不断加入KNO3晶体
表示在20℃时,向一定量的水中不断加入KNO3晶体
D. 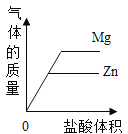 表示等质量的Mg和Zn分别加足量盐酸
表示等质量的Mg和Zn分别加足量盐酸
【答案】B
【解析】
A、向稀盐酸中不断滴加氢氧化钠溶液,酸性逐渐减弱,碱性逐渐增强,pH值的变化是从小于7逐渐的增大到大于7,故选项图象能正确反映对应变化关系,不符合题意;
B、铁与硝酸银溶液反应生成硝酸亚铁溶液和银,反应的化学方程式为Fe+2AgNO3═Fe(NO3)2+2Ag,由反应时的质量比可知,每56份质量的铁可置换出216份质量的银,固体的质量会增加,至完全反应不再发生改变,故选项图象不能正确反映对应变化关系,符合题意;
C、20℃时,向一定量的水中不断加入KNO3晶体,溶质的质量逐渐增加,溶质质量分数逐渐增大,至达到饱和状态,不再发生改变,故选项图象能正确反映对应变化关系,不符合题意;
D、等质量镁、锌分别和足量稀盐酸反应,若消耗盐酸相同,则生成氢气质量相同,故开始两斜线重合,后因盐酸过量,镁消耗盐酸多,生成氢气多,拐点高些,故选项图象能正确反映对应变化关系,不符合题意。
故选B。

【题目】某同学设计如下几组实验,探究某些酸、碱、盐之间的复分解反应能否发生。
已知:BaSO4是白色固体,难溶于水,也不与盐酸反应。
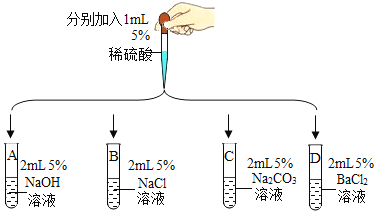
(第一组)选取5种溶液,如图所示进行实验。
实验 |
| ||
现象及结论 | 试管A和B中无明显现象,不能确定反应是否发生 | 试管C中产生_____(填实验现象)。复分解反应已发生 | 试管D中有白色沉淀产生。复分解反应已发生 |
解释 | 试管C中减少的微粒是_____(填微粒符号) | 反应的化学方程式为_____ | |
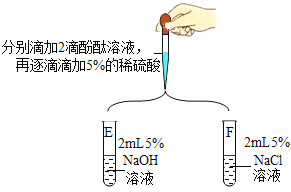
(第二组)对试管A和B中是否发生反应再探究,如图所示进行实验。
实验 |
| |
现象及结论 | 试管E中,滴加酚酞溶液后,溶液由无色变为红色;滴加一定量稀硫酸后,溶液由红色变为无色。复分解反应已发生 | 试管F中始终无明显现象,不能确定反应是否发生 |
解释 |
从微观粒子变化的角度分析试管E中反应的实质是_____ | |
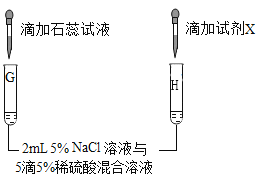
(第三组)对试管B中是否发生反应继续探究,如图所示进行实验。
实验 |
| |
现象及结论 | 试管G中溶液变红 | 向试管H中滴加_____(填“试剂X”的化学式)溶液后,有白色沉淀产生 |
解释 | 该实验的目的是为了检验试管G的溶液中存在 | 溶液中有SO42-存在 |
结论 | NaCl溶液与稀硫酸不发生复分解反应 | |
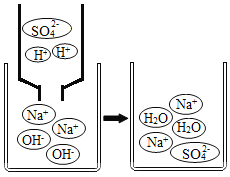
【题目】钠是一种活泼金属,常温下能与氧气.水等物质发生反应。钠与水反应生成氢氧化钠和氢气。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤液的成分进行探究。
请写出钠与水反应的化学方程式:________
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:__
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想__不合理,理由是___。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | __ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想__成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属_(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
【题目】菱镁矿中主要含MgCO3、FeCO3和SiO2。以菱镁矿为原料制取镁的工艺流程如下。
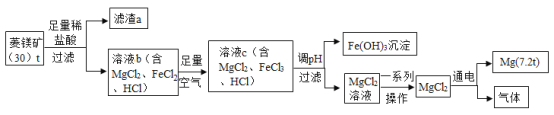
回答下列问题:
(1)菱镁矿属于___(选填“纯净物”或“混合物”)。
(2)流程中滤渣a主要成分是___。
(3)写出菱镁矿中MgCO3与稀HC1反应的化学方程式___。
(4)溶液b→溶液c反应的化学方程式为:![]() (补充完方程式)____。
(补充完方程式)____。
(5)溶液c调pH使Fe2+完全沉淀为Fe(OH)3从而与Mg2+分离,则调pH的范围应为2.8-__。
已知:物质沉淀的pH见下表:
物质 | Mg(OH)2 | Fe(OH)3 |
开始沉淀的pH | 8.9 | 1.5 |
完全沉淀的pH | 10.9 | 2.8 |
(6)结合流程中的数据计算。
①菱铁矿中镁元素的质量分数为_____(不考虑整个流程转化中的损失)。
②MgCl2通电制得的气体的质量____(写出计算过程)。