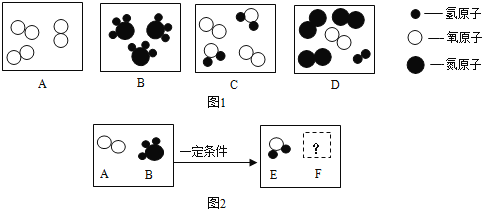
题目内容
【题目】某品牌碳酸钠试剂中含有少量氯化钠杂质,为测定试剂中碳酸钠的质量分数,达瓦取12g样品于烧杯中,加入154.4g水充分溶解,再逐滴滴入7.3%的盐酸溶液,所加盐酸溶液的质量与产生气体质量的关系如图所示.(反应原理:Na2CO3+HCl=2NaCl+H2O+CO2↑).请计算:

(1)完全反应时,产生二氧化碳的质量是___________?
(2)样品中碳酸钠的质量分数是___________?(计算结果精确到0.1%)
(3)完全反应时,所得溶液的溶质质量分数___________?
【答案】4.4g 88.3% 5%
【解析】
(1)设反应的碳酸钠的质量为x,生成的氯化钠质量为y,生成的二氧化碳质量为z,
反应的氯化氢的质量为:100g×7.3%=7.3g,
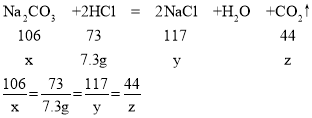
x=10.6g,y=11.7g,z=4.4g,
答:生成二氧化碳的质量是4.4g.
(2)样品中碳酸钠的质量分数为:![]() ×100%≈88.3%,
×100%≈88.3%,
答:样品中碳酸钠的质量分数为88.3%.
(3)完全反应时,所得溶液的溶质质量分数为:![]() ×100%=5%,
×100%=5%,
答:完全反应时,所得溶液的溶质质量分数为5%.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某公司生产的新型融雪剂,其成分是无水CaCl2和少量的NaCl,为测定CaCl2的含量,同学称取该样品12g,加水充分溶解成溶液,然后取一定质量分数的Na2CO3溶液分五次加入,充分振荡,实验数据见表。取你分析数据并进行诱导计算。
次数 | 1 | 2 | 3 | 4 | 5 |
加入Na2CO3溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表x=_________。
(2)样品中CaCl2的质量分数________。
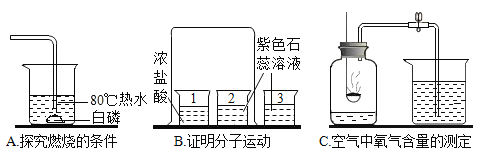
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验:
(实验一)(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤1.检验装置的气密性,气密性良好 |
步骤2.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧 | |
步骤3.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧 | |
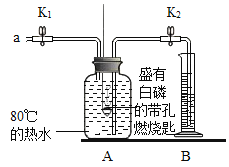
步骤4.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2,此时进入量筒B中水的体积为120ml,观察A瓶中的白磷燃烧 |
(1)请写出白磷燃烧的化学方程式____________;
(2)对比步骤2和4的现象可知,可燃物燃烧的条件之一是_______________;
(3)待装置冷却一段时间后,打开K2,如果观察到__________,说明空气中氧气的体积约占1/5。若实验测得空冬中氧气的体积分数小于1/5,原因可能是________(答一条即可).
(实验二)(已知:铜能与空气中的氧气、水、二氧化碳反应生成铜绿,反应应的化学方程式为:2Cu+O2+H2O+CO2=Cu2(OH)2CO3)
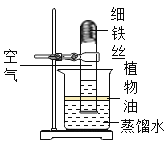
(4)用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量,图中植物油的作用是_________。荐将此装置中的细铁丝换成足量的细铜丝进行实验,不能较准确地测出空气中氧气的含量,请说明理由_____________。