��Ŀ����
����Ŀ��ijͬѧҪ̽��ȼ�յ������Ϳ����������ĺ���,����������ʵ�飺
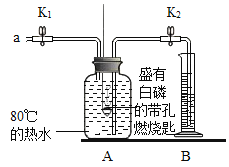
��ʵ��һ��(��֪:�����Ż��Ϊ40��)
ʵ��װ�� | ʵ�鲽�輰���� |
| ����1.����װ�õ������ԣ����������� |
����2.��ʢ�а��Ĵ���ȼ�ճ�����Aƿ�У����ײ�ȼ�� | |
����3.��Aƿ�м���80����ˮ������ƿ�������ײ�ȼ�� | |
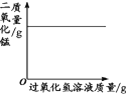
����4.��K1��K2����a����ƿ�й����������ƿ�е�Һ�����ȼ�ճײ�ʱ���ر�K1��K2����ʱ������ͲB��ˮ�����Ϊ120ml,�۲�Aƿ�еİ���ȼ�� |
��1����д������ȼ�յĻ�ѧ����ʽ____________��
��2���ԱȲ���2��4�������֪,��ȼ��ȼ�յ�����֮һ��_______________��
��3����װ����ȴһ��ʱ���,��K2,����۲쵽__________��˵�����������������Լռ1/5����ʵ���ÿն����������������С��1/5,ԭ�������________(��һ������).
��ʵ�����(��֪:ͭ��������е�������ˮ��������̼��Ӧ����ͭ��,��ӦӦ�Ļ�ѧ����ʽΪ:2Cu+O2+H2O+CO2=Cu2(OH)2CO3)
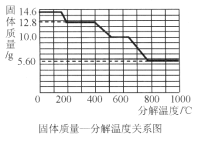
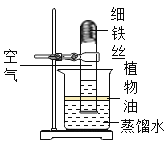
��4������ͼ��ʾװ��,�����������ԭ��Ҳ���ԱȽ�ȷ�ز�������������ĺ���,ͼ��ֲ���͵�������_________��������װ���е�ϸ��˿����������ϸͭ˿����ʵ��,���ܽ�ȷ�ز�������������ĺ���,��˵������_____________��
���𰸡�4P+5O2![]() 2P2O5 �¶ȴﵽ�Ż�� ˮ������Aƿ24mL �����Բ��ã���δ��װ����ȴ�ʹ��ӵȣ� ��ֹ�����е������ܽ���ˮ�� ��Ϊ�����ж�����̼����Լֻ��0.03%��ͭ���ܽ�װ���е����������ľ�
2P2O5 �¶ȴﵽ�Ż�� ˮ������Aƿ24mL �����Բ��ã���δ��װ����ȴ�ʹ��ӵȣ� ��ֹ�����е������ܽ���ˮ�� ��Ϊ�����ж�����̼����Լֻ��0.03%��ͭ���ܽ�װ���е����������ľ�
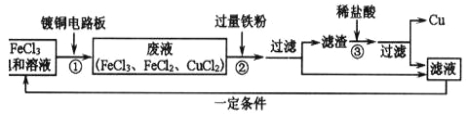
��������
[ʵ��һ]��1�����������ڵ�ȼ�������·�Ӧ�������������ף��ʴ�Ϊ��4P+5O2![]() 2P2O5��
2P2O5��
��2����ȼ��ȼ�յ��������������Ӵ����ﵽ�Ż�㣬������еİ����������Ӵ������¶�û�дﵽ�����Ż�㣬������еİ����������Ӵ����¶ȴﵽ�����Ż�㣬���ͨ���Աȿɵó���ȼ��ȼ�յ�����֮һ���¶ȴﵽ��ȼ����Ż�㣻�ʴ�Ϊ���¶ȴﵽ�Ż�㣻
��3�����ĵ�����Ӧ����120mL��1/5=24mL����۲쵽��������ˮ������Aƿ24mL��Ӱ��ʵ����ƫС�����ؿ����������Բ��á�δ��װ����ȴ�ʹ��ӵȣ��ʴ�Ϊ��ˮ������Aƿ24mL�������Բ��ã���δ��װ����ȴ�ʹ��ӵȣ���
[ʵ���]ͼ��ֲ���͵������Ƿ�ֹ�����е������ܽ���ˮ�У�ͭ���������������ˮ��������̼��Ӧ����ʴ������ͭ��[ͭ�̵���Ҫ�ɷ�Ϊ[Cu2��OH��2CO3]������װ���е���˿����������ͭ˿����ʵ�飬���ܱȽ�ȷ�زⶨ�����������ĺ�������Ϊ�����ж�����̼����Լֻ��0.03%��ͭ���ܽ�װ���е����������ľ����ʴ�Ϊ����ֹ�����е������ܽ���ˮ�У���Ϊ�����ж�����̼����Լֻ��0.03%��ͭ�������ĵ�����Ķ�����̼��������ͭ���ܽ�װ���е����������ľ���

 Сѧ�̲�ȫ��ϵ�д�
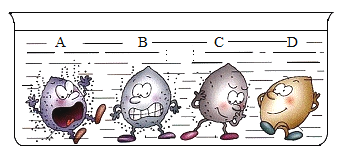
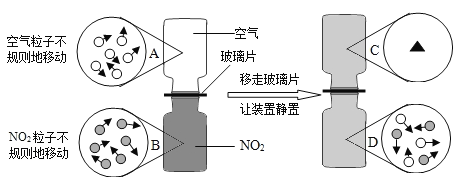
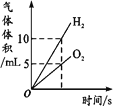
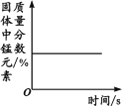
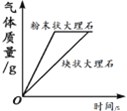
Сѧ�̲�ȫ��ϵ�д�����Ŀ������ͼ������ȷ��ӳ��Ӧ�仯��ϵ����
|
|
|
|
A����ˮͨ����һ ��ʱ�� | B������һ�����ĸ� ����ع��� | C����������������Ŀ�״����ʯ�ͷ�ĩ״����ʯ�зֱ��������ĵ�Ũ�ȵ�ϡ���� | D����һ�����Ķ��������м������������Һ |
A. A B. B C. C D. D
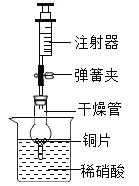
����Ŀ����ѧС������ͼ��ʾ����װ�ý�������������ͺ�������ɷ�����̽����
��������裩������������ж�����̼�ĺ���������������
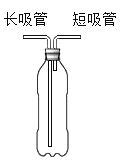
������ʵ�飩
ʵ�� 1
���� | ���� | ���� |
�� | ������ƿ��װˮ��û�������ܵˣ����Ŷ����ܻ������� | ˮ�ӳ����ܶ˿������� |
�� | ������ƿ��װ��ˮ�����Ŷ̹ܴ���������ˮ���ռ��������壬��ȼ�ŵ�ľ��������������ƿ�� | ����ƿ��ľ��Ϩ�� |
�� | ��ˮ������������ƿ�м������ʯ��ˮ��û�������ܵף��Ӷ����ܶ����� 30 �룬�۲�ʯ��ˮ�ı仯���ٴӳ����ܶ˴��� 30 �룬 �۲�ʯ��ˮ�ı仯 |
(1)�����˵��������װ�õ�������_______(��������������������)��
(2)���Ͳ�����г�����Ӧʵ�������ԭ��______��
(3)������е�����_______(������������������)֤�����������к�������̼��ԭ����______��
(4)�����������������У�Ԥ�ڻ�۲쵽��������_______��
ʵ��2
ʵ��1����ͬѧ���֣�����һ��ʱ����֣����ǵ�ʯ��ˮ���±�ó��塣��������װ�ü�����ʵ��1�������ʯ��ˮ��������ʵ�����о���һ���⡣
ʵ���� | ʯ��ˮŨ�� | ��������ʱ�� | ƿ������ |
2��1 | 0.16% | 30 �� | ����ʯ��ˮ����� |
2��2 | 0.16% | 2 ���� | ����ʯ��ˮ�ȱ���ǣ����ֱ�ó��� |
2��3 | 0.08% | 30 �� | |
2��4 | 0.08% | 2 ���� | ����ʯ��ˮ�ȱ���ǣ����ֱ�ó��� |
����˼�����ۣ�
(5)��˵��ʯ��ˮ���±������ʯ��ˮŨ���йص�ʵ����______(��ʵ����)��
(6)ʵ����У�����ʱ���Ϊ 30 �룬��ͬѧ�۲쵽ʯ��ˮ����壬���е�ѧ��δ�۲쵽�������������Ŀ���ԭ����________��