题目内容
【题目】某研究小组测定Cu -Fe合金和Fe -Al合金中铁的质量分数。向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气,则下列说法正确的是 ( )
A.当粉末为Fe -Al合金时,a可能为0.2g
B.当粉末为Cu -Fe合金时,反应完全后,生成物的溶液里一定含有Fe2+和Cu2+
C.当粉末为Cu -Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50%
D.当粉末为Fe -Al合金时,所需稀硫酸溶质质量分数一定大于9.8%
【答案】CD
【解析】
金属活动性顺序表中,在氢元素前面的金属能将氢元素从稀硫酸或盐酸中置换出来。
A、当粉末为Fe -Al合金时,根据平均值法可知,5.6g铁和铝分别和稀硫酸反应生成氢气质量等于或大于0.2g,所以a一定大于0.2g,不符合题意;
B、当粉末为Cu -Fe合金时,铜不与稀硫酸反应,反应完全后,生成物的溶液里不可能有Cu2+,不符合题意;
C、当粉末为Cu -Fe合金时,只有铁和稀硫酸反应生成氢气,该种合金中含铁的质量分数为50%,即有2.8g铁,完全反应生成氢气质量为![]() ,符合题意;
,符合题意;
D、根据质量守恒定律可知,氢气的质量等于稀硫酸中溶质硫酸中的氢元素质量。根据平均值法可知,5.6g铁和铝分别和稀硫酸反应生成氢气质量等于或大于0.2g,所以氢气一定大于0.2g,所以所需稀硫酸溶质质量一定大于100g×9.8%,即所需稀硫酸溶质质量分数一定大于9.8%,符合题意。
故选CD。

【题目】回答实验室用高锰酸钾制取氧气的相关问题。
(1)写出制取原理的符号表达式_____________.
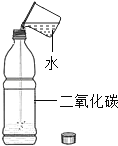
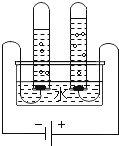
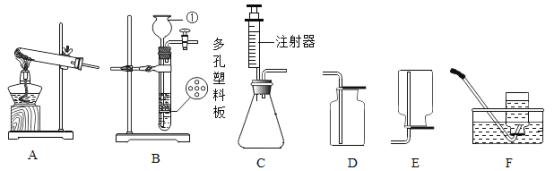
(2)如下图所示,若要制取并收集一瓶干燥的氧气,应选用______(填编号,下同)
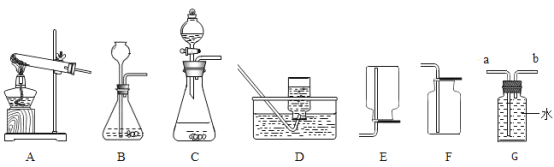
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是___;如果用图G所示装置收集乙炔,气体应从___(填“a”或“b”)端口通入。
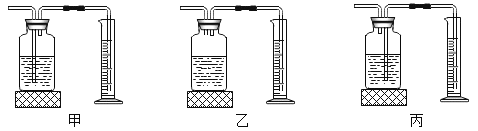
(4)为测定高锰酸钾分解生成氧气的体积,应选用下图装置___(填编号).
(5)实验结束,某同学发现收集到的纯氧气质量大于通过计算所得质量。不考虑实验误差,请你就此提出一种猜想并设计相应验证方案:
猜想 | 验证方案 |
___________________________ | ___________________________ |
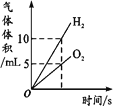
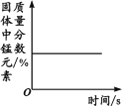
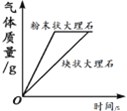
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
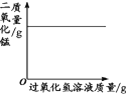
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D