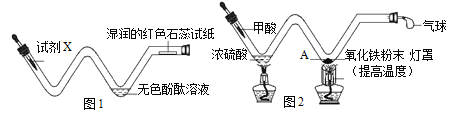
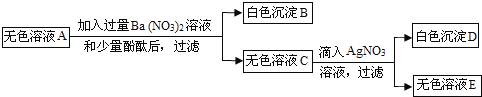
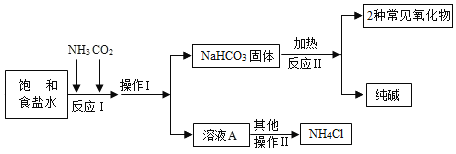
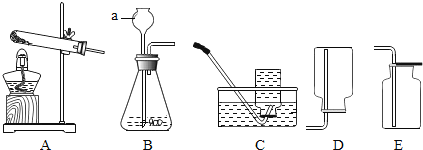
题目内容
【题目】某化学兴趣小组同学为回收一块质量为26g的铜锌合金中的铜。将该合金放入烧杯中,滴加稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,过滤,得滤渣和滤液,将滤渣洗涤晾干称重为19.5g。再向反应后的滤液中加入54.7g水进行稀释。请计算:
(1)黄铜中锌的质量_____;
(2)所用稀硫酸中溶质的质量分数_____;
(3)滤液加水稀释后,所得溶液中溶质的质量分数_____。
【答案】6.5g 9.8% 10%
【解析】
(1)26g铜锌合金中锌的质量为26g﹣19.5g=6.5g。故填:6.5g。
(2)设所用稀硫酸中溶质的质量为x,反应后生成的硫酸锌质量为y,生成的氢气质量为z。
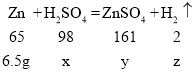
则![]() ,解得x=9.8g,y=16.1g,z=0.2g。
,解得x=9.8g,y=16.1g,z=0.2g。
所用稀硫酸中溶质的质量分数:![]() 。故填:9.8%。
。故填:9.8%。
(3)所得溶液的溶质质量分数=![]() 。故填:10%。
。故填:10%。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】Na2CO3和NaHCO3有相似的化学性质,都能与酸、某些碱反应。但碳酸钠稳定,而 NaHCO3受热分解:2NaHCO3![]() X+H2O+CO2↑。
X+H2O+CO2↑。
(1)生成物X的化学式为______。
(2)工业上用碳酸钠制烧碱的化学反应方程式为______。
(3)同学们在探究其化学性质实验后,将剩余固体药品集中放在烧杯中。小明为了弄清剩余固体的成份,进行了如下的探究:
(提出猜想)剩余固体是:I.Na2CO3;Ⅱ.NaHCO3;Ⅲ.______。
(进行实验)
操作 | 现象 | 结论 |
①取少量剩余固体于试管中,加入足量水,充分溶解后,滴加几滴酚酞溶液。 | 溶液由无色变红色。 | 剩余固体一定有: ______ 。 |
②取适量剩余固体于试管中,固定在铁架台上,充分加热。 | 白色固体质量减少, 试管内壁有较多水珠出现。 |
(结论分析)
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想______也有相同现象。
②同学们讨论后认为,如要确定剩余固体成分,小明只要做实验操作②,并补充操作______,再通过______即可得出结论。
(拓展反思)
有同学提出,碳酸钙和碳酸氢钙能不能互相转化呢?小明认为可以,因课本“资料卡片”中介绍的《石笋和钟乳石的形成》就是“CaCO3→Ca(HCO3)2→CaCO3”的过程。则“CaCO3→Ca(HCO3)2”化学反应方程式为______。