题目内容
【题目】有一包粉末,已知由CaCO3、CuSO4、MgCl2、Na2SO4、NaOH、NaNO3中的几种组成,为确定其组成,现进行以下实验(各步骤均充分反应):
①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀硝酸,得到无色气体和蓝色溶液;
③将①步得到的无色溶液A进行如图所示的实验: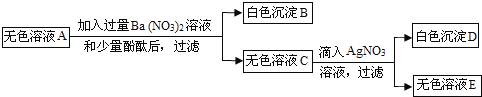
回答下列问题:
(1)D 的化学式是_______;
(2)A中一定存在的溶质的化学式是_______;
(3)生成白色沉淀B 的化学方程式是_______;
(4)这包粉末中可能含有的物质的化学式是_______。
【答案】AgCl Na2SO4、NaCl Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 Na2SO4、NaNO3
【解析】
碳酸钙难溶于水,氯化铜在溶液中显蓝色,硫酸钠和氯化钡反应生成不溶于酸的硫酸钡沉淀,氢氧化钠和氯化镁反应生成溶于酸的氢氧化镁沉淀,碳酸盐和酸反应会生成二氧化碳气体,氯离子和银离子反应生成氯化银沉淀,
①碳酸钙难溶于水、硫酸铜溶液显蓝色、硫酸铜和氢氧化钠会生成硫酸钠和蓝色的氢氧化铜沉淀、氯化镁和氢氧化钠会生成氯化钠和白色的氢氧化镁沉淀,原粉末中可能含有CaCO3、CuSO4、MgCl2、NaOH、Na2SO4;
②碳酸钙与稀硝酸反应生成无色气体二氧化碳,氢氧化铜与稀硝酸反应会生成硝酸铜的蓝色溶液可知,硫酸钡沉淀不溶于酸,原粉末中一定含有CaCO3、CuSO4、NaOH,可能含Na2SO4、NaNO3;
③硫酸钠(可能是硫酸铜与氢氧化钠反应生成的,也可能是原粉末中含有的)和硝酸钡反应生成硝酸钠和硫酸钡沉淀,所以A中一定含有硫酸钠,①步得到的无色溶液A中含有的氯化钠和硝酸银反应生成硝酸钠和氯化银沉淀,所以A中一定含有NaCl,故原粉末中一定含有MgCl2,综上所述原粉末中可能含有Na2SO4、NaNO3。
由分析可知(1)D 的化学式是AgCl;
(2)A中一定存在的溶质的化学式是:Na2SO4、NaCl;
(3)生成白色沉淀B 的反应是硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,化学方程式是:Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3;
(4)这包粉末中可能含有的物质的化学式是:Na2SO4、NaNO3。

 阅读快车系列答案
阅读快车系列答案【题目】目前使用的燃料大多来自化石燃料。
(1)写出天然气中甲烷完全燃烧的化学方程式______。
(2)分析下表,与煤相比,用天然气作燃料的优点有______。
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
煤碳 | 3.67 | 32 |
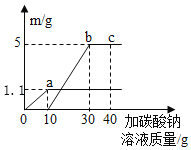
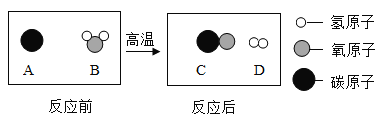
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,则生成物的分子个数比为_____。
【题目】设计对比实验是实验探究的重要方法。
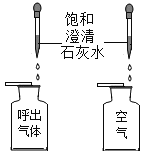
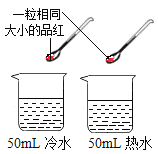
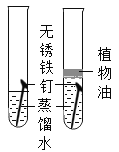
实验 编号 | 一、探究人体呼出气体中二氧化碳含量比空气中的高 | 二、品红扩散的探究 | 三、铁钉锈蚀条件的探究 |
实验 设计 |
|
|
|
实验 分析 | (1)本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制____相同。 | (2)该实验的目的是____。 | (3)一周后,左边试管中铁钉生锈。探究铁生锈的条件,还应该补充的实验是____。 |