题目内容
【题目】空气是一种宝贵的资源。请回答下列问题:
(1)清洁的空气对于人类非常重要,下列做法有利于保护大气的是_______ (填序号,下同)。
a使用清洁能源 b燃放烟花爆竹 c大量植树 d推广私家汽车出行
(2)空气中下列气体过多会引起温室效应的是_______
a二氧化氮 b一氧化碳 c二氧化碳 d二氧化硫
(3)空气污染指数与质量状况的对应关系:
污染指数 | 0-50 | 51-100 | 101-200 | 201-300 | 301以上 |
质量状况 | 优 | 良 | 普通 | 不佳 | 差 |
某市区某天的空气污染指数为48,首要污染物为:可吸入颗粒物。根据以上信息,判断该市区当天的空气质量状况是(____________)
A优 B良 C轻度污染 D重度污染
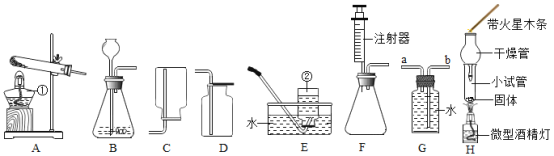
(4)某化学兴趣小组用红磷测定空气中氧气含量,分6组测定(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积/ml | 20 | 21 | 15 | 20 | 22 | 19 |
根据上述测定,计算空气中氧气体积分数为_________________
【答案】ac c A 20.4%
【解析】
(1)使用清洁能源、大量植树,有利于保护大气,而燃放烟花爆竹、推广私家汽车出行会增加空气污染物,因此做法有利于保护大气的是:ac。
(2)二氧化氮、一氧化碳、二氧化硫是有害气体,对空气有污染,但不会造成温室效应,空气中二氧化碳过多会造成温室效应,因此排放过多会引起温室效应的是:二氧化碳。
(3)根据题中表格提供的信息,空气污染指数为48,在0~50之间,空气质量状况为优。因此该市区当天的空气质量状况是:A。
(4)根据题中提供的数据,其中第三组数据偏差较大,因此舍去。由其余五组数据可以计算出100mL空气中氧气的平均体积为:![]() ,空气中氧气体积分数为
,空气中氧气体积分数为![]() 。
。

【题目】小玲同学在探究二氧化锰在过氧化氢分解中作催化剂中,设计了以下探究实验。请根据题意答题
(1)实验报告
实验步骤 | 用带火星的木条检验时的现象 |
I.向试管①中倒入5mL30%的过氧化氢溶液 | 不复燃 |
Ⅱ.给试管①稍微加热,如图甲 | 不复燃 |
Ⅲ.向试管②中加入5mL30%的过氧化氢溶液和少量二氧化锰 | 产生大量气泡,带火星的木条复燃 |
(2)小玲在步骤Ⅱ的装置中,加装了一个U形管(如图乙装置)后,带火星的木条较易复燃。利用图甲装置做实验时,带火星的木条难复燃的原因是______________ ;改用乙装置后带火星的木条能够复燃,装置中冰水的作用是__________
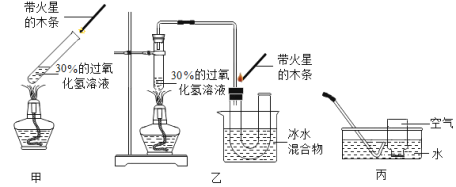
(3)小玲由此还想到了一个问题:能使带火星的木条复燃的气体一定是纯氧气吗?
小玲设计的实验如下:如丙图所示,按下表所示比例,用排水法收集部分氧气,分别得到五瓶空气和氧气的混合气体,进行木条复燃的实验。请你帮他将下表实验现象填写完全。
实验编号 | 空气体积分数% | 排水积分数% | 带火星的木条复燃情况 |
1 | 85 | 15 | 火星稍变亮,不复燃 |
2 | 80 | 20 | 火星明亮,时燃时不燃 |
3 | 75 | 25 | 复燃 |
4 | 70 | 30 | 复燃 |
5 | 50 | 50 | 复燃 |
通过以上实验,可以得出结论是__________小玲还能够粗略得出:使带火星的木条复燃的气体中氧气体积分数的范围是____________。
(4)小玲通过步骤Ⅲ得出二氧化锰能加快过氧化氢分解的结论,但小玮同学提出质疑:过氧化氢溶液由水和过氧化氢组成,也可能是二氧化锰加快水的分解产生氧气。请你设计一个实验证明小玮的猜想_____(请写出操作步骤和实验现象)
【题目】过氧化氢俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气和水。查阅资料:
①将新制的浓度5%的双氧水加热到65℃时就有氧气产生,加热到80℃时就有较多氧气产生。
②若在相同质量5%的双氧水中加入少量二氧化锰固体,常温下就会立即产生氧气,反应速度快,所需时间短。
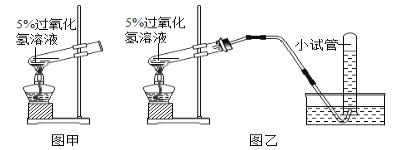
请根据上图回答问题:
(1)请你写出用双氧水和二氧化锰混合物制取氧气的反应文字表达式:____________
(2)小红按图甲装置进行实验,当试管中有大量气泡出现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中带火星木条未复燃的原因是__________________。
(3)以下是某小组同学探究影响过氧化氢分解速率部分因素的相关实验数据。
实验序号 | H2O2溶液 浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 5 | 20 | 0.1 | 4 | 16.75 |
② | 15 | V | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
①V=________:从实验_________和__________(填序号)对比可知,过氧化氢分解速率与过氧化氢溶液浓度有关。从表中实验数据对比可知,过氧化氢分解速率与温度的关系是:___
②用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总质量__(填“减小”“不变”或“增大”)。
(注意:若正确回答下列问题加4分,总分不超过60分)
③除了上述影响因素外,过氧化氢分解生成氧气的速率还与哪些因素有关?请你继续探究。(写出一种假设,并设计实验方案)
(你的假设)___________
(设计方案)
实验方法及步骤 | 可能观察到的实验现象 | 实验结论 |
_________ | _________ | 假设正确 |