题目内容
【题目】工业上常通过下列流程来吸收处理二氧化硫:
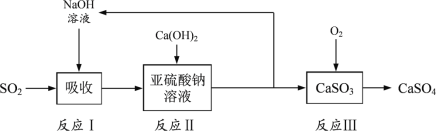
(资料卡片)CaSO3 在通常状况下是一种白色固体,难溶于水。
(1)大气中的 SO2 对环境的影响主要是______(填字母)。
A 加剧温室效应 B 形成酸雨 C 造成臭氧空洞
(2)Ca(OH)2 的俗名是______;CaSO3 中硫元素的化合价为______;反应Ⅲ属于___选填“分解”、“化合”、“置换”或“复分解”)反应。
(3)写出流程中反应Ⅱ的化学方程式:______。
(4)上述流程中,可循环利用的物质是______。
(5)除了上述方法之外,还可以单独使用Ca(OH)2 或NaOH 分别来吸收处理SO2。根据下表数据可知:和 NaOH 相比,用Ca(OH)2 吸收处理SO2 的优缺点分别是________(填字母)。
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 1 kg SO2 的成本(元) | 0.422 | 3.625 |
20℃时在水中的溶解度(g) | 0.166 | 109 |
A 优点:成本高;缺点:吸收慢
B 优点:成本低;缺点:吸收快
C 优点:成本高;缺点:吸收快
D 优点:成本低;缺点:吸收慢
【答案】B 熟石灰(或消石灰) +4 化合 Na2SO3+Ca(OH)2=CaSO3↓+2NaOH 氢氧化钠(或NaOH) D
【解析】
(1)根据酸雨是因为空气中的污染物二氧化硫、氮氧化合物等过多造成的。
(2)根据常见物质的俗称以及化合价的算法、反应的基本类型进行解答。
(3)根据化学方程式的书写方法进行解答。
(4)根据反应II中生成的氢氧化钠可以用于反应I中吸收SO2进行解答。
(5)分析数据表格的不同点进行解答。
(1)造成温室效应的气体是CO2,酸雨是因为空气中的污染物二氧化硫、氮氧化合物等过多造成的,制冷剂“氟里昂”等,对臭氧层有很大的破坏作用,会使臭氧层形成空洞;故填:B。
(2)氢氧化钙俗称熟石灰或消石灰,CaSO3中钙元素的化合价为+2价,氧元素的化合价为-2价,根据化合物中化合价代数和为0,设硫元素的化合价为x,则:(+2)+x+(-2)×3=0,得x=+4。反应Ⅲ是氧气和亚硫酸钙反应生成硫酸钙,符合多变一,所以是化合反应。故填:熟石灰(或消石灰);+4;化合。
(3)流程Ⅱ中氢氧化钙和亚硫酸钠反应生成亚硫酸钙的沉淀和氢氧化钠,反应的化学方程式为:Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。故填:Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。
(4)反应II中生成的氢氧化钠可以用于反应I中吸收SO2,故填:氢氧化钠(或NaOH)。
(5)根据表格中的数据对比可知:吸收1kgSO2,氢氧化钙的成本更低,但是在相同温度下氢氧化钙的溶解度明显比氢氧化钠低了很多导致了它吸收SO2时候速度较慢。故选:D。

 阅读快车系列答案
阅读快车系列答案【题目】为测定一种含碳酸钙的“石头纸”中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品,分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
则求:(1)表中X的值为________;
(2)求样品中碳酸钙的质量分数________;
(3)烧杯④中物质充分反应后所得溶液的质量为____g。