��Ŀ����
ʵ������һƿ���ܲ������Լ�����ͼ�������ȱ�ı�ǩ��ֻʣ�¡�Na���͡�10%����������֪������ɫҺ�壬�dz��л�ѧ���õ��Լ���
��1�����������ǩ������жϣ���ƿ�Լ���������
A���� B���� C����
��2�� ��֪ ���л�ѧ�����ĺ��ƻ�������NaCl��NaOH��Na2CO3��NaHCO3��
��Na2CO3��NaHCO3��Һ���ʼ��ԡ�
�����£�20�棩ʱ���������ʵ��ܽ�ȵ���������ͼ��
| ���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
| �ܽ��g | 36 | 109 | 215 | 9��6 |
�����Լ�ƿ��ע��������������10%���ұ��е��ܽ�ȵ������жϣ���ƿ�Լ��������� ��
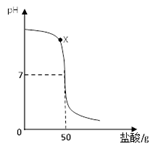
��3�� ��pH��ֽ�ϲ�ø���Һ��pH��7����ƿ�Լ��������� ��
��4�� Ϊ��ȷ������Һ��������Һ���ֽ������½�һ����ʵ�飺
| �������� | ʵ������ | ���ۼ���ѧ����ʽ |
| ȡ�����Թ��У��μ� | �������������� | ����Һ�� ����Ӧ�Ļ�ѧ����ʽ |
��6�� Ϊ��̽��һƿ�Ȼ�����Һ������������ȡ����Һ50g������50g̼�����Һ��ǡ����ȫ��
Ӧ��������Һ����95g��������Ȼ�����Һ������������
��1�� A ��2�� NaHCO3��3�� NaCl
��4�� ϡ���ᣨ��ϡ���ᣩ̼������Һ Na2CO3+2HCl�T2NaCl+H2O+CO2��
��5�� CaCl2 [ ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� ]
��6�� 11��1%��
����������������������ǩ������жϣ������к�����Ԫ�أ��ǽ���Ԫ�أ���������ε���ɣ���ƿ�Լ����������ᣬ��������ʱ�����ʵ��ܽ�ȣ������̼�����Ƶı�����Һ����������������Ҳ��������10%��������ƿҩƷ����ʹ̼�����ƣ���pH��ֽ�ϲ�ø���Һ��pH��7��˵������Һ�Լ��ԣ����Ȼ�����Һ�����ԣ����Բ��������Ȼ��ƣ����Ը�ƿ��Һ�������������ƻ���̼���ƣ���֤������ȡ������Ʒ���Թ��еμ�ϡ���ᣬ�������������ݣ�����Һ��̼������Һ����Ӧ�ķ���ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2����������ѡ���루4���в�ͬ���Լ�ȷ������Һ��ֻҪ�ܺ�̼���Ʒ�����Ӧ�ģ����磺CaCl2 ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� �����ԣ�����ʱ������ɫ���������һ���Ǹ��ݻ�ѧ����ʽ���м��㣬
�⣺��ԭ��Һ��CaCl2������Ϊx
CaCl2+K2CO3�TCaCO3��+2KCl
111 100
x ��50g+50g��95g��
111/100==x/(50g+50g---95g) x ==5��55g
����Һ����CaCl2����������Ϊ��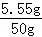 ��100%=11��1%
��100%=11��1%
������CaCl2��Һ����������11��1%��
���㣺��Һ�ɷֵķ�����������ʵļ��飬���ݻ�ѧ����ʽ���м���

С��ͬѧ��ѧϰ������й�֪ʶʱ����һЩ�������ʵ���ɫ��������Ȥ����ʦ������������ͭ����ɫ�����������Ǻ��ɫ�������Լ�̽����������������ɫ�������������һ��̽����
���������ϡ�
��1��������������������ǿ��Էֱ������Ӧ�Ŀ������������Һ��Ӧ���Ƶá�
��2�������������ڿ�����������������
��3������ͭ��Һ����ɫ������������Һ��dz��ɫ��
��������롿
������������dz��ɫ��
��ʵ����̡�
��2֧�Թ���ֱ��������FeCl3��FeSO4��Һ��Ȼ�����NaOH��Һ���۲������벹������±���
| | FeCl3��Һ | FeSO4��Һ |
| ����NaOH��Һ������ | ���ɺ��ɫ���� | �����ɰ�ɫ��״������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ������ |
| ��ѧ����ʽ | �� | FeSO4+2NaOH = Fe(OH)2��+Na2SO4 Fe(OH)2 + �� + H2O = �� (��ɲ���ƽ�˻�ѧ����ʽ) |
��1�������������� �� ɫ������dz��ɫ��
��2��С����ϵ��CO2��C�ķ�Ӧ����ΪFeCl3��Һ����ת��ΪFeCl2��Һ������ΪС���������� �� ��
��10�֣���ѧϰ�ε�����ʱ��ij��ͬѧ��̼������Һ��һƿ��ǩ�������ҺM����ͼ��
���з�Ӧ���а�ɫ�������������˺�õ�������Һ��ͬѧ�ǶԸ�ʵ�������һϵ�е�̽����
����̽����
̽��һ��M��Һ�е�������ʲô��
��1����������롿����ͬѧ��ΪM��Һ�����������ֿ��ܣ�
���� ��
����CaCl2.
���ռ����ϡ�CaCl2ˮ��Һ�����ԡ�
��2�������ʵ�顿ͬѧ����������·���������ʵ�飺
| ʵ����� | ʵ������ | ʵ����� |
| ȡ����M��Һ���Թ��У������еμ� | | �������ȷ��̼�������䷴Ӧ�Ļ�ѧ����ʽΪ |
̽�������˺������Һ�л�����Щ���ʣ�
��������롿����һ��NaOH ��Na2CO3 ��
������� ��
��������NaOH ��
��3����ʵ����֤��ͬѧ�Ǿ����������ۣ��������ʵ�鷽��ȷ����Һ�����ʵ���ɣ�
| ʵ����� | ʵ������ | ʵ����� |
| �ֱ�ȡ������Һ��A��B��֧�Թ��У�A�м���CaCl2��Һ�� B�м��� ��Һ | ��A�в�����ɫ������B��û�г��� | ������һ������ |
| | ������������� | |
| | �������������� |
����̽����
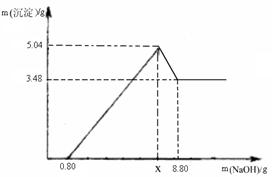
��������⡿���˺������Һ��NaOH�����������Ƕ��٣�
�����ʵ�顿
С��ͬѧȡ100g���˺������Һ���ձ��У����ձ�����μ��������ϡ���ᣬ������������������ϡ����������ϵ����ͼ��ʾ��������˺������Һ��NaOH�����������Ƕ��٣������г�������̣�
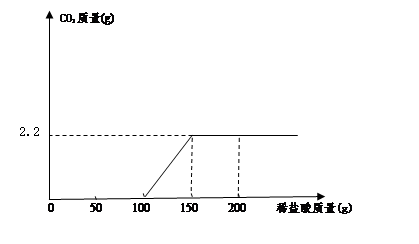
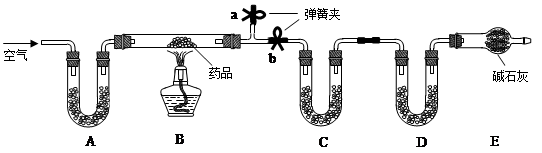
��7�֣�Ŀǰ���Ͼɵ�ضԻ�������Ⱦ��Խ��Խ�������ǵ����ӡ�Ϊ��ʵ�ֿɳ�����չ��ս��Ŀ�꣬������ʶ֮ʿ�����о��Ͼɵ�ص���Ч����������
��������ͼΪ��ͨ��أ�п�̵�أ�ʾ��ͼ���������ͼʾ
�����ش�
��1���Ͼɵ���ں��е�һ���л��������� ____��
��2��С��ͬѧ��õ����д�������Ķ������̺��Ȼ����
Һ���������Ȼ���е�笠����ӡ����������ʵ�飬
��ش�
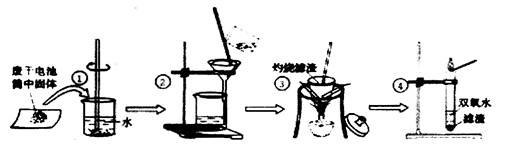
ʵ��ٲ�������������
ʵ��ڹ��˺���Һ��Ȼ���ǣ�����ɻ��ǵ�ԭ����� �����ţ�
| A����ֽ���� | B�����˹�������Һ��Һ�泬������ֽ�ı�Ե |
| C���ձ����ɾ� | D����ҺC�е��������Ӧ |
ʵ��ܵķ�Ӧ����ʽ
��3���Ȼ���е�笠����Ӽ��鷽������С�Թ�ȡ������Һ���μ�����������Һ���ȣ��� ��ֽ�����Թܿڣ������������֤����Һ�к���笠����ӡ���Ӧ����ʽΪ
��6�֣����ݱ��е�Ԫ������ɳ��л�ѧ���������ʣ��ش��������⡣
| Ԫ������ | �� | ̼ | �� | �� | �� | �� |
| Ԫ�ط��� | H | C | O | Cl | Na | Ca |
��1��A��B���Ԫ����ͬ��һ�������¿ɷ�����ӦA��B+C����C������______��
��2��D��E��F������ͬ�Ľ���Ԫ�أ�F�׳�С�մ���֪����Һ��D��F��Ӧ����E��B����÷�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��3����ij��ɫ��Һ�еμ�D��Һ����Һ��ɫ������ɫ����ɫ����ɫ�ı仯���̣��������塢������������ԭ��ɫ��Һ�е�������_______________��D������______________��
��4����X���ʵı�����Һ�м�������Y����Һ����ǣ��������м�������ϡ���ᣬ��Һ����塢���������������Һ����ǵ�ԭ����__________[�����]��
��X��Ca(OH)2�����������Y��CO2�����߷�����Ӧ����CaCO3��
��X��Na2CO3�����������Y��Ca(OH)2�����߷�����Ӧ����CaCO3��
��X��Ca(OH)2�����������Y��CaO��CaO��ˮ��Ӧ�����ܼ�ʹCa(OH)2������
��X��Ca(OH)2�����������Y��CaO��CaO��ˮ��Ӧ���ɵ�Ca(OH)2�������ܽ⣻
��X��Ca(OH)2�����������Y��CaO��CaO��ˮ��Ӧ����ʹCa(OH)2�ܽ�ȼ�С��������