题目内容
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
(提出问题)瓶口白色固体的成分是什么?
(查找资料)(1)玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来;
(2)二氧化硅能与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O;
(3)硅酸钠(Na2SiO3)是一种白色固体,有很强的粘合性,可溶于水,溶液呈碱性:硅酸钠溶液能与强酸反应,如:Na2SiO3+2HCl=2NaCl+H2SiO3↓(白色):硅酸钠溶液能与氯化钙溶液反应:Na2SiO3+CaCl2=2NaCl+CaSiO3↓(白色)。
(作出猜想)白色固体的成分是:
I.硅酸钠
Ⅱ.硅酸钠和碳酸钠;
Ⅲ.硅酸钠、碳酸钠和氢氧化钠。
(实验探究)取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论评价 | ||
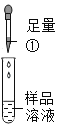
第 一 组 |
| 有气泡冒出,且产生白色沉淀 | 同学们认为猜想I②_____(成立或不成立):写出生成气体的化学方程式③________ | |
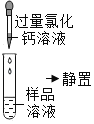
第二组 | 第一步 |
| 产生白色沉淀 | 第1组同学认为:此步骤还不能准确判断出原固体的成分 |
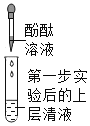
第二步 |
| ④_______ | 大家一致认为:猜想Ⅱ成立 | |
(反思交流)
(1)第2组实验第一步中加入过量氯化钙的作用是⑤_____。
(2)有同学认为,第2组实验中不能用氢氧化钙溶液代替氯化钙溶液,理由是⑥_____。
(3)氢氧化钠溶液必须密封保存,且试剂瓶只能用⑦_____。
【答案】稀盐酸 不成立 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 溶液不变色 除去碳酸钠、硅酸钠 碳酸钠和氢氧化钙反应生成氢氧化钠,影响检验氢氧化钠 橡皮塞
【解析】
{实验探究{第一组}有气泡冒出,是因为碳酸钠和盐酸反应生成了二氧化碳气体,所以加入的试剂为稀盐酸,故填稀盐酸;
加入稀盐酸后,不仅产生气体,还产生白色沉淀,是因为稀盐酸和硅酸钠反应生成了硅酸,说明白色固体中含有硅酸钠,所以猜想I不成立,故填不成立;
生成气体是碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳的缘故,故反应的化学方程式写为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
{第二组}猜想Ⅱ成立,溶液中不含有氢氧化钠,加入酚酞试液,溶液不变色,故填溶液不变色。
{反思交流}(1)碳酸钠、硅酸钠均能与氯化钙反应生成沉淀,所以第2组实验第一步中加入过量氯化钙的作用是除去碳酸钠、硅酸钠,故填除去碳酸钠、硅酸钠。
(2)有同学认为,碳酸钠和氢氧化钙反应生成氢氧化钠,影响检验氢氧化钠,所以第2组实验中不能用氢氧化钙溶液代替氯化钙溶液,故填碳酸钠和氢氧化钙反应生成氢氧化钠,影响检验氢氧化钠。
(3)氢氧化钠溶液必须密封保存,为避免玻璃瓶塞中的二氧化硅能与氢氧化钠溶液反应生成硅酸钠,所以试剂瓶只能用橡皮塞,故填橡皮塞。

 黄冈创优卷系列答案
黄冈创优卷系列答案