题目内容
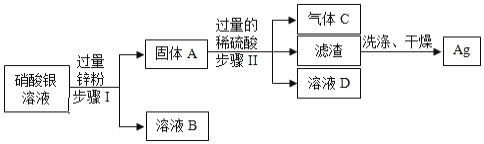
【题目】人类社会的发展离不开金属材料。如图是某硬铝的主要成分及相关实验。


(1)将未打磨过的硬铝放入足量稀硫酸中,整个过程中的实验现象是__________(填字母)
A先无气泡产生,后有大量气泡产生 B立即产生大量气泡 C无气泡产生
(2)将打磨过硬铝片放入硫酸铜溶液中,写出涉及到的一个化学反应的方程式___________。
(3)将一定量硝酸银溶液滴入盛放有硬铝粉末的试管中,充分反应后,过滤,得到滤渣和滤液。若滤渣中加入稀盐酸无气泡产生,则滤渣中一定含有的金属是___________。
【答案】A 2Al+3CuSO4=Al2(SO4)3+3Cu Ag
【解析】
(1)未打磨过的硬铝表面有致密的氧化铝,放入足量稀硫酸中,稀硫酸先与氧化铝反应,生成硫酸铝和水,氧化铝反应完后,稀硫酸与铝反应,生成硫酸铝和氢气,所以整个过程中的可以观察到先无气泡产生,后有大量气泡产生。故选A。
(2)将打磨过硬铝片放入硫酸铜溶液中,铝与硫酸铜反应生成铜和硫酸铝,或者镁与硫酸铜反应生成铜和硫酸镁,化学反应的方程式可以为2Al+3CuSO4=Al2(SO4)3+3Cu。
(3)将一定量硝酸银溶液滴入盛放有硬铝粉末的试管中,充分反应后,过滤,在滤渣中加入稀盐酸无气泡产生,说明固体中没有铝和镁,则铝和镁已完全反应,固体中一定有银生成,但铜不与稀酸反应,无法证明固体中是否有铜,因此,滤渣中一定含有银,一定没有铝和镁,可能有铜。

 名校课堂系列答案
名校课堂系列答案【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
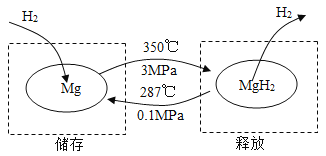
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |