题目内容
【题目】实验探究是化学学习的重要方法,下列实验设计能实现相应实验目的是( )
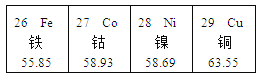
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
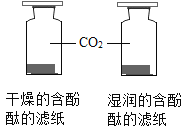
A | 探究CO2与水反生反应 |
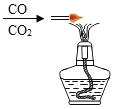
| B | 除去CO2中少量的CO |
|
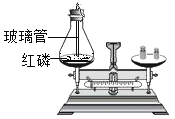
C | 验证质量守恒定律 |
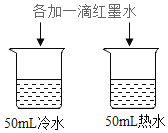
| D | 探究温度对分子运动快慢的影响 |
|
A. A B. B C. C D. D
【答案】D
【解析】
A、二氧化碳与水反应生成碳酸,碳酸不能使无色酚酞溶液变色,不能探究CO2与水反生反应,故不符合题意;
B、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故不符合题意;
C、红磷在带有玻璃管的容器中燃烧,反应物中有气体参加,反应没有在密闭容器中进行,不能用来验证质量守恒定律,故不符合题意;
D、图中实验,除温度不同外,其它条件相同,可探究温度对分子运动快慢的影响,故符合题意。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】小明同学想在实验室用NaOH溶液与CO2气体制取Na2CO3溶液。但是经过检验,发现很难得到纯净的Na2CO3溶液,在老师的帮助下查阅了相关资料,制定了计划。
【查阅资料】
①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象。
②NaHCO3溶液煮沸时不会发生分解反应;NaHCO3溶液与CaCl2溶液不反应
③NaHCO3+NaOH=Na2CO3+H2O
④Na2CO3+CaCl2=CaCO3↓+2NaCl
【制取步骤】
①量取两份50 mL相同浓度的NaOH溶液备用;
②用一份50 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1-2分钟;
④在得到的③的溶液中加入另一份50 mL NaOH溶液,使其充分混合即得。
【实验探究】制得的Na2CO3溶液中可能含有的杂质是___________。
为检验制得的溶液是否为纯净的Na2CO3溶液,请你与小明同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的显中性的CaCl2溶液 | ________。 | 溶液中含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的____, | 无气泡产生 | 制得的溶液中不含_____, |
取另一份加入______, |
| 制得的溶液中含NaOH | |
【结论】所制得的不是纯净的Na2CO3溶液。
【评价与反思】小芳同学认为可以用过量的Ca(OH)2溶液替代CaCl2溶液进行以上实验,你认为是否可行,并说明原因_______________。
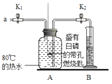
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验:
(实验)(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤1检查装置的气密性,气密性良好。 步骤2将盛有白磷的带孔燃烧匙伸入A瓶(空瓶)中,白磷不燃烧。 步骤3向A瓶中加满80℃热水,寒紧瓶塞,白磷不燃烧。 步骤4打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量简B中水的体积为100mL,观察到A瓶中的白燃烧。 |
(1)请写出白磷燃烧的化学方程式______。
(2)对比步骤3和4的现象可知,可燃物燃烧的条件之一是______。
(3)待装置冷却一段时间后,打开K2,如果观察到______,说明空气中氧气的体积约占,但实验测得空气中氧气的体积分数小于,原因可能是______(答一条即可)。
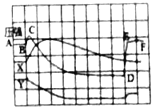
(交流)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置内的压强、温度和氧气浓度,三条曲线变化趋势如图所示。
(4)其中Y曲线表示的是______(填“温度”或“氧气的浓度”)。
(反思)
(5)解释压强曲线BC段变化的原因是______;DE段变化的原因是______。